모세관 전기영동법(Capillary Electrophoresis, CE)을 혹시 들어보셨나요? 아마 생소하게 느끼시는 분들이 많을 것입니다. 하지만 분석화학, 특히 생화학이나 제약 분야에서는 매우 중요하고 강력한 분리 분석 기술 중 하나로 꼽힙니다. 마치 머리카락처럼 가느다란 관 안에서 전기의 힘을 이용해 물질들을 정밀하게 분리해내는 기술이라고 생각하시면 이해가 쉬울까요? 기존의 겔 전기영동이나 액체 크로마토그래피(HPLC)와는 또 다른 매력을 가진 분석법인데요.

이번 시간에는 바로 이 모세관 전기영동법(CE)의 세계로 깊숙이 들어가 보고자 합니다. 도대체 어떤 원리로 물질을 분리하는지, 그 구체적인 방법들은 무엇이 있는지, 그리고 실제로 어떤 분야에서 어떻게 활용되고 있는지, 기초적인 개념부터 시작해서 아주 상세하고 깊이 있게 파헤쳐 볼 예정입니다.
CE에 대해 전혀 배경지식이 없는 분이라도 이 글을 끝까지 읽으시면 CE의 핵심 원리를 완벽하게 이해하고, 그 응용 가능성까지 명확하게 파악하실 수 있도록 하는 것이 이 글의 핵심 목표입니다. 따라서 단순한 정보 나열이 아닌, 왜 그런 원리가 작동하는지, 각 단계는 어떤 의미를 가지는지 근본적인 이해를 돕는 데 초점을 맞출 것입니다.
모세관 전기영동법(CE)의 기본 원리
모세관 전기영동법(CE)의 핵심은 이름 그대로 '모세관'과 '전기영동'의 원리를 결합한 것입니다. 그렇다면 먼저 '전기영동(Electrophoresis)'이 무엇인지부터 알아야겠지요? 전기영동이란 전기장(electric field) 내에서 하전된 입자(charged particle)나 분자가 이동하는 현상을 말합니다. 쉽게 말해, 전기를 걸어주면 (+) 전하를 띤 물질은 (-) 전극 쪽으로, (-) 전하를 띤 물질은 (+) 전극 쪽으로 끌려가게 됩니다.

이때 이동하는 속도가 물질의 전하량(charge), 크기(size), 모양(shape) 그리고 매질의 점도(viscosity) 등 여러 요인에 따라 달라지게 됩니다. 바로 이 이동 속도의 차이를 이용하여 서로 다른 물질들을 분리하는 것이 전기영동의 기본 원리인 것입니다. 마치 다양한 무게와 모양의 돌멩이들을 강물에 흘려보내면 가볍고 작은 돌멩이가 더 빨리 떠내려가는 것과 비슷하다고 생각할 수 있습니다.
그렇다면 모세관 전기영동법(CE)은 기존의 겔(gel) 전기영동과 무엇이 다를까요? 가장 큰 차이점은 분리가 일어나는 장소가 겔 매트릭스가 아닌 아주 가느다란 용융 실리카(fused silica) 모세관(capillary) 내부라는 점입니다. 이 모세관은 내경이 보통 20~100 마이크로미터(µm) 정도로 매우 좁습니다. 머리카락 굵기 정도라고 생각하시면 됩니다. 이렇게 좁은 모세관을 사용하는 데에는 몇 가지 중요한 이유가 있습니다.
첫째, 높은 분리 효율(high separation efficiency)을 달성할 수 있습니다. 모세관의 표면적 대 부피 비율이 매우 크기 때문에, 전기영동 과정에서 발생하는 줄 열(Joule heat)을 효과적으로 방출할 수 있습니다. 줄 열은 전류가 흐를 때 발생하는 열인데, 이 열이 제대로 방출되지 않으면 매질 내에 온도 구배가 생기고 대류 현상이 일어나 분리능을 심각하게 저하시킵니다.
하지만 CE에서는 열 방출이 매우 효율적이어서 매우 높은 전압을(수십 kV) 걸어줄 수 있게 됩니다. 높은 전압은 물질의 이동 속도를 증가시키고 분리 시간을 단축하며, 동시에 확산(diffusion)에 의한 피크 넓어짐(peak broadening)을 최소화하여 매우 날카롭고 분리가 잘 된 피크를 얻을 수 있게 해주는 것입니다. 즉, 수십만에서 수백만 플레이트 수(plate number, N)에 달하는, HPLC보다 훨씬 높은 분리 효율을 나타내는 핵심적인 이유가 바로 여기에 있습니다.
둘째, 극소량의 시료만으로도 분석이 가능합니다. 모세관의 부피가 매우 작기 때문에 주입되는 시료량 역시 나노리터(nL) 수준으로 매우 적습니다. 이는 귀중한 시료나 양이 제한적인 생체 시료 분석에 매우 유리한 장점입니다.
셋째, 분석 시간이 매우 빠릅니다. 높은 전압을 사용할 수 있고 모세관 길이가 상대적으로 짧기 때문에 분리가 수 분 내에 완료되는 경우가 많습니다. 이는 대량의 시료를 신속하게 처리해야 하는 경우 큰 장점이 됩니다.
하지만 CE의 원리를 완벽하게 이해하기 위해서는 반드시 알아야 할 또 하나의 핵심적인 현상이 있습니다. 바로 전기삼투 흐름(Electroosmotic Flow, EOF)입니다. 이것을 이해하지 못하면 CE에서 왜 양이온, 음이온, 심지어 중성 분자까지 모두 한 방향으로 이동하는지 설명할 수 없습니다.
전기삼투 흐름(Electroosmotic Flow, EOF)의 이해

전기삼투 흐름(EOF)은 모세관 전기영동에서 나타나는 매우 독특하고 중요한 현상입니다. 이것은 전기장 하에서 모세관 내벽 표면과 용액 사이의 상호작용에 의해 발생하는 용액 전체의 이동(bulk flow) 을 의미합니다. 이게 도대체 무슨 말일까요?
용융 실리카(fused silica)로 만들어진 모세관의 내벽은 특정 pH 조건(보통 pH 3 이상)에서 표면의 실라놀기(Si-OH)가 해리되어 음전하(Si-O⁻)를 띠게 됩니다. 모세관 내부는 전해질 용액(buffer)으로 채워져 있는데, 이 음전하를 띤 벽면 근처에는 용액 속의 양이온들이 끌려와 이중 전기층(electric double layer)을 형성하게 됩니다. 이때, 벽면에 단단히 붙어있는 내부 층(Stern layer)과, 그 바깥쪽으로 느슨하게 분포하며 이동 가능한 외부 층(diffuse layer)으로 나눌 수 있습니다.
여기에 높은 전압을 걸어주면 어떻게 될까요? 외부 층에 존재하는 과잉의 양이온들이 전기장에 의해 음극(-) 쪽으로 이동하게 됩니다. 이때 이 양이온들은 주변의 용매 분자들을 함께 끌고 가게 되는데, 마치 강물이 흐르듯 모세관 내부의 용액 전체가 음극 쪽으로 이동하는 흐름이 만들어집니다. 이것이 바로 전기삼투 흐름(EOF)인 것입니다. EOF의 속도는 모세관 벽의 전하 밀도(즉, 실라놀기의 해리 정도), 용액의 이온 강도, 점도, 그리고 인가된 전기장의 세기에 따라 달라집니다.
EOF가 왜 중요할까요? EOF는 마치 컨베이어 벨트처럼 작용하여, 모세관 내의 모든 종류의 분자(양이온, 음이온, 중성 분자)를 검출기(detector)가 위치한 음극 쪽으로 이동시키는 역할을 합니다. 전기영동 자체만 생각하면, 양이온은 음극으로, 음이온은 양극으로 이동해야 합니다. 하지만 CE에서는 대부분의 경우 EOF의 속도가 이온 자체의 전기영동 이동 속도(electrophoretic mobility)보다 훨씬 빠릅니다.

따라서 양이온은 EOF 방향과 같은 방향으로 빠르게 이동하고, 중성 분자는 전하가 없으므로 전기영동으로는 이동하지 않지만 EOF에 의해 음극 쪽으로 이동합니다. 심지어 음이온조차도 양극(+)으로 이동하려는 전기영동 속도보다 EOF의 속도가 더 빠르면, 결국에는 음극 쪽으로 끌려가게 되는 것입니다. 물론, 음이온은 EOF에 저항하며 이동하므로 양이온이나 중성 분자보다는 늦게 검출됩니다.
결과적으로, 일반적인 CE 조건(pH > 3, 음극 쪽에 검출기 설치)에서는 양이온 → 중성 분자 → 음이온 순서로 검출기에 도달하게 됩니다. 만약 EOF가 없다면 음이온은 검출기에 도달하지 못할 수도 있습니다. 이처럼 EOF는 CE 분리 메커니즘의 핵심이며, 모든 종류의 분석물을 하나의 검출기로 검출할 수 있게 해주는 중요한 원동력입니다.
아래 표는 전기영동 이동성과 전기삼투 흐름의 관계를 요약한 것입니다.
| 분석물 종류 | 전기영동 이동성 ($\mu_{ep}$) 방향 | 전기삼투 흐름 ($\mu_{eof}$) 방향 | 겉보기 이동성 ($\mu_{app} = \mu_{ep} + \mu_{eof}$) 방향 | 검출 순서 (일반적 CE) |
|---|---|---|---|---|
| 양이온 (Cation) | 음극 (-) 방향 | 음극 (-) 방향 | 음극 (-) 방향 (빠름) | 가장 먼저 |
| 중성 분자 (Neutral) | 없음 (0) | 음극 (-) 방향 | 음극 (-) 방향 (EOF 속도) | 중간 |
| 음이온 (Anion) | 양극 (+) 방향 | 음극 (-) 방향 | 음극 (-) 방향 (느림, $\mu_{eof} > | \mu_{ep} |
여기서 $\mu_{ep}$는 전기영동 이동성(electrophoretic mobility) 으로, 단위 전기장 하에서 이온이 이동하는 속도를 나타냅니다. 이는 이온의 전하량에 비례하고 크기(스토크스 반경)에 반비례합니다. $\mu_{eof}$는 전기삼투 흐름 이동성을, $\mu_{app}$는 우리가 실제로 관찰하는 겉보기 이동성(apparent mobility)을 의미합니다. 즉, 분석물의 실제 이동 속도는 이 두 힘의 벡터 합으로 결정되는 것입니다.
EOF는 또한 제어가 가능합니다. 예를 들어, 완충 용액의 pH를 변화시키면 실라놀기의 해리 정도가 달라져 벽면 전하 밀도가 바뀌고 EOF 속도가 조절됩니다. pH가 높을수록 실라놀기 해리가 증가하여 음전하 밀도가 높아지고 EOF는 빨라집니다. 반대로 pH를 낮추면 EOF는 느려지고, 등전점(pI, 약 pH 2-3) 이하에서는 EOF 방향이 역전될 수도 있습니다.
또한, 완충 용액의 농도(이온 강도) 를 높이면 이중 전기층의 두께가 얇아져 EOF가 느려집니다. 계면활성제 같은 첨가제를 사용하거나 모세관 내벽을 화학적으로 코팅하여 표면 전하를 바꾸거나 중성화시켜 EOF를 조절하거나 억제할 수도 있습니다. 이러한 EOF 조절은 특정 분리 목적에 맞게 분석 조건을 최적화하는 데 매우 중요합니다.
CE의 뛰어난 분리 효율과 이론 단수

앞서 언급했듯이, CE는 매우 높은 분리 효율을 자랑합니다. 분석화학에서는 분리 효율을 이론 단수(theoretical plate number, N) 라는 개념으로 설명하는데요, 이는 분리 컬럼(여기서는 모세관) 내에서 분석물이 얼마나 효과적으로 분리 평형에 도달하는지를 나타내는 지표입니다. N 값이 클수록 피크는 더 좁고 날카로워지며, 인접한 성분들을 더 잘 분리할 수 있음을 의미합니다.
CE의 이론 단수(N)는 다음 식으로 표현될 수 있습니다.
$N = \frac{\mu_{app} V L}{2 D L} = \frac{(\mu_{ep} + \mu_{eof}) V}{2 D}$
여기서 $\mu_{app}$는 겉보기 이동성, $V$는 인가 전압, $L$은 모세관의 유효 길이(시료 주입구에서 검출기까지의 거리), $D$는 분석물의 확산 계수(diffusion coefficient)입니다.
이 식에서 주목할 점은 이론 단수 N이 인가 전압 V에 직접적으로 비례한다는 것입니다. 즉, 전압을 높일수록 분리 효율이 증가합니다. CE에서는 모세관의 뛰어난 열 방출 능력 덕분에 매우 높은 전압(예: 30 kV)을 사용할 수 있으므로, 극도로 높은 N 값을 얻을 수 있는 것입니다. 일반적인 HPLC의 N 값이 수만 정도인 것에 비해, CE는 수십만에서 때로는 백만 이상의 N 값을 달성할 수 있습니다.
또한, CE에서의 피크 넓어짐(band broadening)은 주로 종축 확산(longitudinal diffusion)에 의해 지배됩니다. 기존의 충전 컬럼(packed column) 크로마토그래피에서는 컬럼 내 충전 입자 사이의 불규칙한 경로(eddy diffusion)와 충전재 표면에서의 물질 전달 저항(mass transfer resistance)이 피크 넓어짐의 주된 요인이었습니다 (Van Deemter 방정식의 A항과 C항).
하지만 CE는 충전재가 없는 개방형 튜브(open tubular) 시스템이므로 이러한 요인들이 거의 없습니다. 오직 분자가 용액 내에서 무작위로 퍼져나가는 확산(Van Deemter 방정식의 B항)만이 주된 피크 넓어짐의 원인이 됩니다. 따라서 CE는 본질적으로 매우 좁은 피크를 얻는 데 유리한 구조를 가지고 있는 것입니다.
결론적으로, 모세관 전기영동법은 전기영동 원리와 모세관의 독특한 특성(높은 열 방출 효율, 개방형 튜브 구조), 그리고 전기삼투 흐름(EOF)이라는 현상이 복합적으로 작용한 결과, 매우 높은 분리 효율과 빠른 분석 속도, 낮은 시료 소모량이라는 장점을 가지는 강력한 분리 분석 기술이라고 할 수 있습니다. 이것이 바로 CE가 다양한 분야에서 각광받는 이유입니다.
모세관 전기영동법(CE)의 구성 장치

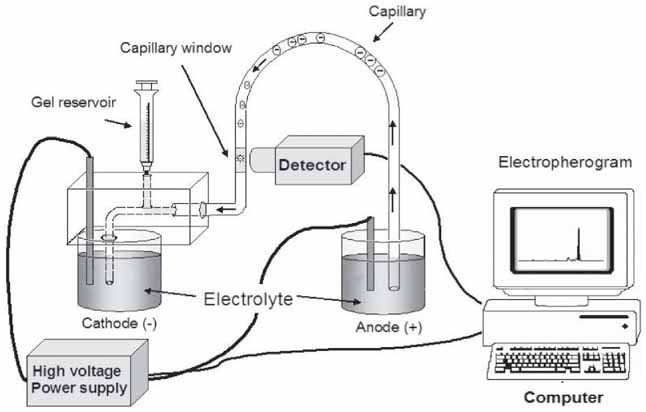
그렇다면 실제로 모세관 전기영동 분석은 어떤 장치들을 이용해서 수행될까요? CE 시스템은 비교적 간단한 구성 요소들로 이루어져 있지만, 각 부분은 정밀한 분리를 위해 중요한 역할을 담당합니다. 주요 구성 요소를 서술형으로 살펴보겠습니다.
CE 시스템의 핵심은 모세관(Capillary) 입니다. 이곳은 분리가 실제로 일어나는 핵심 공간으로, 주로 용융 실리카(fused silica) 재질로 만들어집니다. 외부 충격으로부터 보호하고 취급을 용이하게 하기 위해 폴리이미드(polyimide) 코팅이 외부에 입혀져 있습니다. 내경은 보통 20-100 µm, 외경은 200-400 µm, 길이는 20-100 cm 정도가 일반적으로 사용됩니다. 모세관의 일부(보통 검출기 위치)는 폴리이미드 코팅을 제거하여 투명한 창(detection window)을 만들어 빛이 통과할 수 있도록 합니다. 모세관의 내경, 길이, 그리고 내벽 표면 상태는 분리 효율, 분석 시간, EOF 등에 직접적인 영향을 미칩니다. 필요에 따라 내벽을 특정 물질로 코팅하여 분석물과의 상호작용을 조절하거나 EOF를 제어하기도 합니다.
다음으로 완충 용액 저장 용기(Buffer Reservoirs / Vials) 는 모세관의 양 끝을 담그는 용액 용기입니다. 하나는 주입구(inlet) 쪽, 다른 하나는 배출구(outlet) 쪽에 위치하며, 각각 전극(electrode)이 담겨 있습니다. 이 용기들은 완충 용액(buffer 또는 background electrolyte, BGE)을 담고 있으며, 전기 회로를 완성하고 모세관 내부에 일정한 전기장을 형성하는 역할을 합니다. 시료는 보통 주입구 쪽 용기에서 모세관으로 주입됩니다. 완충 용액의 조성(pH, 이온 강도, 첨가제 등)은 분리 선택성(selectivity)과 효율에 결정적인 영향을 미치므로 신중하게 선택해야 합니다.
CE 분리의 원동력인 전기장을 생성하는 장치는 고전압 전원 공급 장치(High Voltage Power Supply, HVPS)입니다. 보통 0에서 30 kV 범위의 직류(DC) 전압을 안정적으로 공급할 수 있어야 합니다. 전압의 크기와 극성(polarity)을 조절하여 분석물의 이동 속도와 방향, 그리고 EOF를 제어합니다. 높은 전압은 빠른 분리와 높은 효율을 가능하게 하지만, 과도한 줄 열 발생을 유발할 수 있으므로 최적의 전압 설정이 중요합니다.
시료 주입 시스템(Injection System)은 극미량의 시료를 재현성 있게 모세관 안으로 주입하는 장치입니다. CE에서는 나노리터(nL) 수준의 매우 적은 양을 주입해야 하므로 정밀한 제어가 필수적입니다. 주로 두 가지 방식이 사용됩니다. 첫 번째 방식은 유체 동력학적 주입(Hydrodynamic Injection)입니다. 이는 압력이나 중력, 또는 진공을 이용하여 일정 시간 동안 시료 용액을 모세관 안으로 밀어 넣거나 빨아들이는 방식입니다. 주입량은 압력 차이, 시료 점도, 주입 시간, 모세관 직경에 따라 달라집니다. 비교적 간단하고 보편적으로 사용되지만, 시료의 점도에 영향을 받는다는 단점이 있습니다.
다른 방식으로는 전기 동력학적 주입(Electrokinetic Injection)이 있습니다. 이는 짧은 시간 동안 모세관의 주입구 쪽에 전압을 가하여 시료 용액 중의 이온들을 전기영동 및 EOF에 의해 모세관 안으로 이동시키는 방식입니다. 이 방식은 이동성이 큰 이온들이 더 많이 주입되는 경향이 있어 시료 조성에 편향(bias)이 생길 수 있습니다. 하지만 특정 이온을 농축하여 주입하거나 매우 적은 양을 정밀하게 주입하는 데 유용할 수 있습니다.
분리된 분석물을 실시간으로 감지하는 장치는 검출기(Detector)입니다. 모세관의 일부에 만들어진 투명한 검출 창을 통해 분석물을 검출합니다. 가장 널리 사용되는 검출기는 자외선-가시광선 흡광 검출기(UV-Vis Absorbance Detector)입니다. 특정 파장의 빛을 모세관에 쬐어주고 분석물이 통과할 때 흡수되는 빛의 양 변화를 측정하는 방식입니다. 구조가 간단하고 많은 화합물에 적용 가능하지만, 모세관의 짧은 광 경로(path length) 때문에 감도가 다소 낮다는 단점이 있습니다.

이를 보완하기 위해 레이저 유도 형광 검출기(Laser-Induced Fluorescence, LIF)가 사용되기도 합니다. 특정 파장의 레이저를 쬐어 형광을 내는 분석물이나 형광 표지된 분석물을 매우 높은 감도로 검출할 수 있습니다. DNA 염기서열 분석이나 미량의 생체 분자 분석에 필수적입니다. 그 외에도 질량 분석기(Mass Spectrometry, MS)를 연결한 CE-MS는 분리된 성분의 분자량과 구조 정보를 제공하여 강력한 동정(identification) 능력을 보여줍니다. 또한 전도도 검출기(Conductivity Detector)는 무기 이온 분석에, 전기화학 검출기(Electrochemical Detector)는 전기 활성 물질 분석에 사용될 수 있습니다.
검출기로부터 얻어진 신호를 기록하고 처리하여 전기영동도(electropherogram)를 생성하는 시스템은 데이터 처리 시스템(Data Acquisition and Processing System)입니다. 전기영동도는 시간에 따른 검출기 신호의 변화를 나타낸 그래프로, 각 피크는 분리된 분석물 성분을 나타냅니다. 피크의 위치(이동 시간, migration time)는 성분 동정에 사용되고, 피크의 면적(peak area)이나 높이(peak height)는 정량 분석에 사용됩니다. 소프트웨어를 통해 데이터 분석, 피크 적분, 농도 계산 등을 수행합니다.
마지막으로 온도 조절 시스템(Temperature Control System)은 모세관 주변의 온도를 일정하게 유지하는 장치입니다. 온도는 용액의 점도, 이온의 이동성, EOF, 확산 계수 등에 영향을 미치므로, 재현성 있는 분리를 위해서는 온도를 정밀하게 제어하는 것이 매우 중요합니다. 보통 공기 순환 방식이나 액체 냉각 방식을 사용합니다.
이러한 구성 요소들이 유기적으로 작동하여 모세관 전기영동 분석이 이루어집니다. 비록 기본적인 구성은 간단해 보이지만, 각 부품의 성능과 정밀한 제어가 CE의 뛰어난 분리능과 재현성을 구현하는 데 필수적이라는 점을 기억해야 합니다.
모세관 전기영동법(CE)의 다양한 모드
모세관 전기영동법은 기본적인 원리는 같지만, 분리 메커니즘이나 모세관 내부에 사용하는 매질의 종류에 따라 다양한 '모드(mode)'로 확장될 수 있습니다. 이는 CE의 가장 큰 장점 중 하나로, 분석하고자 하는 시료의 특성(크기, 전하, 소수성 등)에 맞춰 최적의 분리 방식을 선택할 수 있게 해줍니다. 마치 스위스 군용 칼처럼, 하나의 기본 도구에 다양한 기능을 추가하여 활용도를 극대화하는 것과 같습니다. 주요 CE 모드들을 자세히 살펴보겠습니다.
모세관 영역 전기영동(Capillary Zone Electrophoresis, CZE)

CZE는 가장 기본적이고 널리 사용되는 CE 모드입니다. 앞서 설명한 CE의 기본 원리, 즉 완충 용액으로 채워진 모세관 내에서 전기영동 이동성과 전기삼투 흐름(EOF)의 차이를 이용하여 하전된 분석물들을 분리하는 방식입니다. 주된 분리 기준은 분석물의 전하 대 크기 비율(charge-to-size ratio)입니다. 전하가 크고 크기가 작을수록 전기영동 이동성이 커서 더 빠르게 이동합니다 (EOF 방향과 같거나 반대 방향으로).
CZE는 이온성 화합물, 예를 들어 작은 무기 이온, 유기산, 아미노산, 펩타이드, 단백질 등 다양한 크기의 하전된 분자들을 분리하는 데 매우 효과적입니다. 분리 메커니즘이 비교적 간단하고 재현성이 좋으며, 다양한 완충 용액 시스템을 적용하여 분리 선택성을 조절할 수 있습니다.
예를 들어, 완충 용액의 pH를 변화시키면 약산이나 약염기성 분석물의 해리 정도가 달라져 전하 상태가 변하고, 이는 이동 시간에 직접적인 영향을 미쳐 분리 양상을 바꿀 수 있습니다. 또한, 유기 용매나 첨가제를 완충 용액에 추가하여 용해도나 상호작용을 조절함으로써 분리를 개선하기도 합니다.
하지만 CZE는 전기적으로 중성인 분자들을 분리할 수 없다는 명확한 한계가 있습니다. 중성 분자는 전하가 없으므로 전기영동 이동성이 0입니다. 따라서 모든 중성 분자는 EOF를 따라서만 이동하며, 서로 분리되지 않고 하나의 피크로 검출됩니다. 이러한 문제를 해결하기 위해 개발된 모드가 바로 다음에 설명할 MEKC입니다.
미셀 동전기 크로마토그래피(Micellar Electrokinetic Chromatography, MEKC)
MEKC는 중성 분자도 분리할 수 있도록 CZE를 변형시킨 매우 유용한 CE 모드입니다. 어떻게 중성 분자를 분리할 수 있을까요? 그 비밀은 바로 미셀(micelle)이라는 특별한 구조체를 완충 용액에 첨가하는 데 있습니다. 미셀은 계면활성제(surfactant) 분자들이 임계 미셀 농도(critical micelle concentration, CMC) 이상에서 자발적으로 형성하는 구형 또는 타원형의 집합체입니다.
계면활성제 분자는 물을 좋아하는 친수성 머리(hydrophilic head)와 기름을 좋아하는 소수성 꼬리(hydrophobic tail)를 동시에 가지고 있는데, 수용액 속에서 소수성 꼬리들은 서로 안쪽으로 모여 핵(core)을 형성하고 친수성 머리들은 바깥쪽 물을 향하는 구조를 이룹니다. 가장 흔하게 사용되는 계면활성제는 음이온성인 도데실황산나트륨(Sodium Dodecyl Sulfate, SDS)입니다.
MEKC에서는 이 미셀이 마치 크로마토그래피의 정지상(stationary phase)과 유사한 역할을 합니다. SDS 미셀은 음전하를 띤 친수성 머리가 바깥쪽을 향하고 있으므로, 전기장 하에서 CZE의 EOF와 반대 방향(양극 쪽)으로 전기영동 이동을 합니다. 하지만 보통 EOF의 힘이 더 강하기 때문에 미셀 자체도 느리지만 음극 쪽으로 이동하게 됩니다.
이제 중성 분자가 이 시스템에 주입되면 어떻게 될까요? 중성 분자는 미셀의 소수성 내부(hydrophobic core)와 주변의 수용액(aqueous phase) 사이에서 분배 평형(partitioning equilibrium)을 이루게 됩니다. 즉, 분석물의 소수성(hydrophobicity) 정도에 따라 미셀 내부에 머무는 시간과 수용액 상에 머무는 시간이 달라지는 것입니다.
소수성이 강한 분석물일수록 미셀 내부에 더 오래 머무르게 되고, 미셀과 함께 더 느리게 이동하게 됩니다. 반대로 친수성이 강한 분석물은 수용액 상에 더 오래 머물며 EOF와 함께 더 빠르게 이동합니다. 이러한 분배 계수(partition coefficient)의 차이를 이용하여 소수성이 다른 중성 분자들을 성공적으로 분리할 수 있는 것입니다.
MEKC는 중성 분자뿐만 아니라 하전된 분자들의 분리에도 유용하게 사용될 수 있습니다. 하전된 분석물은 전기영동 이동성과 더불어 미셀과의 상호작용(정전기적 인력/반발, 소수성 상호작용)에 의해서도 분리가 영향을 받기 때문에, CZE만으로는 분리가 어려운 이온성 화합물들의 분리 선택성을 향상시키는 데에도 활용됩니다. 특히, 광학 이성질체(chiral enantiomers) 분리에도 키랄 선택제(chiral selector)를 포함하는 미셀을 이용하여 널리 응용되고 있습니다.
결론적으로 MEKC는 CZE의 적용 범위를 중성 분자까지 확장시킨 매우 강력하고 다재다능한 CE 모드라고 할 수 있습니다. 제약 분석, 환경 분석, 식품 분석 등 다양한 분야에서 복잡한 혼합물 속의 중성 및 이온성 성분들을 동시에 분석하는 데 널리 사용됩니다.
아래 표는 CZE와 MEKC의 주요 특징을 비교합니다.
| 특징 | 모세관 영역 전기영동 (CZE) | 미셀 동전기 크로마토그래피 (MEKC) |
|---|---|---|
| 주요 분리 메커니즘 | 전기영동 이동성 ($\mu_{ep}$) 차이 (전하/크기 비율) | 전기영동 이동성 ($\mu_{ep}$) + 미셀과의 분배 평형 차이 (소수성) |
| 분리 대상 | 하전된 분자 (이온, 펩타이드, 단백질 등) | 하전된 분자 + 중성 분자 |
| 완충 용액 | 일반 완충 용액 | 완충 용액 + 계면활성제 (미셀 형성) |
| EOF 역할 | 분석물을 검출기로 이동시키는 주된 흐름 | 분석물 및 미셀을 검출기로 이동 + 미셀의 이동 속도 결정에 기여 |
| 장점 | 간단하고 기본적인 모드, 이온성 물질 분리에 효과적 | 중성 분자 분리 가능, 적용 범위 넓음, 선택성 조절 용이 |
| 단점 | 중성 분자 분리 불가 | 미셀과의 상호작용 예측 어려움, 최적화 필요 |
모세관 겔 전기영동(Capillary Gel Electrophoresis, CGE)
CGE는 전통적인 슬랩 겔 전기영동(slab gel electrophoresis)의 원리를 모세관에 적용한 형태입니다. 슬랩 겔 전기영동은 주로 DNA, RNA, 단백질과 같은 거대 생체 분자들을 크기에 따라 분리하는 데 사용되는 기술입니다. 어떻게 크기 분리가 가능할까요? 이는 겔(gel)이라는 다공성 매트릭스(porous matrix)를 이용하기 때문입니다.
겔은 폴리머 사슬들이 얽혀서 만들어진 그물망 구조를 가지고 있는데, 전기장 하에서 분자들이 이 그물망을 통과할 때 체 거르기(sieving) 효과가 나타납니다. 즉, 크기가 작은 분자는 겔 그물망을 비교적 쉽게 통과하여 빠르게 이동하는 반면, 크기가 큰 분자는 그물망에 더 자주 부딪히고 통과하기 어려워 느리게 이동하게 됩니다.
CGE에서는 이러한 겔 매트릭스를 모세관 내부에 채워서 사용합니다. 겔은 화학적으로 가교된 영구적인 겔(cross-linked gel)일 수도 있고, 가교되지 않은 선형 또는 분지형 폴리머 용액(linear or branched polymer solution)일 수도 있습니다. 후자의 경우, 사용 후 쉽게 교체할 수 있어 더 편리하게 사용됩니다. 흔히 사용되는 폴리머로는 폴리아크릴아미드(polyacrylamide), 폴리에틸렌옥사이드(polyethylene oxide, PEO), 하이드록시에틸셀룰로오스(hydroxyethylcellulose, HEC) 등이 있습니다. 폴리머의 종류와 농도, 분자량 등을 조절하여 겔의 기공 크기(pore size)를 변화시킴으로써 분리하고자 하는 분자 크기 범위에 맞는 최적의 분리능을 얻을 수 있습니다.
CGE의 가장 중요한 응용 분야는 바로 DNA 염기서열 분석(DNA sequencing)과 DNA 단편 분석(DNA fragment analysis)입니다. 특히 자동화된 DNA 염기서열 분석 장비의 핵심 기술로 사용되어 인간 게놈 프로젝트(Human Genome Project)와 같은 대규모 연구를 가능하게 했습니다. 형광 표지된 DNA 단편들을 CGE로 크기에 따라 정밀하게 분리하고 레이저 유도 형광(LIF) 검출기로 검출함으로써 염기서열 정보를 고속으로 해독할 수 있습니다.
또한, 단백질 분석에서는 SDS-PAGE(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis)의 원리를 모세관에 적용한 SDS-CGE가 사용됩니다. SDS를 처리하여 모든 단백질에 일정한 음전하를 부여하고 변성시킨 후, CGE로 분리하면 단백질의 크기(분자량)에 따라서만 분리가 일어나게 되어 단백질의 순도 분석이나 분자량 측정에 유용합니다.
CGE는 자동화가 용이하고, 분리 효율이 높으며, 분석 시간이 빠르고, 시료 소모량이 적다는 장점을 가지고 전통적인 슬랩 겔 전기영동을 빠르게 대체해 나가고 있습니다.
모세관 등전점 전기영동(Capillary Isoelectric Focusing, cIEF)
cIEF는 단백질이나 펩타이드와 같이 양쪽성 전해질(ampholyte)의 특성을 가진 분자들을 분리하는 데 특화된 강력한 기술입니다. 양쪽성 전해질이란 분자 내에 산성기와 염기성기를 모두 가지고 있어 용액의 pH에 따라 양전하, 음전하 또는 순 전하가 0인 상태(양쪽성 이온, zwitterion)로 존재할 수 있는 물질을 말합니다. 각 양쪽성 전해질 분자는 고유한 등전점(isoelectric point, pI) 값을 가지는데, 이는 분자의 알짜 전하(net charge)가 정확히 0이 되는 pH 값을 의미합니다.
cIEF의 핵심 원리는 모세관 내부에 안정적인 pH 구배(pH gradient)를 형성하고, 이 pH 구배 내에서 분석물들이 각자의 등전점(pI)에 해당하는 위치에 도달하여 '집속(focusing)'되도록 하는 것입니다. 어떻게 pH 구배를 만들까요? 모세관에 캐리어 양쪽성 전해질(carrier ampholytes)이라고 불리는, 다양한 pI 값을 가지는 저분자량 양쪽성 전해질 혼합물을 채워 넣습니다. 모세관의 양 끝에는 각각 산성 용액(anolyte, 예: 인산)과 염기성 용액(catholyte, 예: 수산화나트륨)을 넣고 고전압을 걸어줍니다. 그러면 캐리어 양쪽성 전해질들이 자신의 pI 값에 따라 이동하여 모세관 내부에 양극(+) 쪽은 낮은 pH, 음극(-) 쪽은 높은 pH를 가지는 선형적인 pH 구배를 형성하게 됩니다.
이제 단백질 시료를 이 pH 구배가 형성된 모세관에 주입하면 어떻게 될까요? 특정 단백질 분자는 자신이 위치한 곳의 pH에 따라 양전하 또는 음전하를 띠게 됩니다. 만약 단백질이 자신의 pI보다 낮은 pH 영역에 있다면 양전하를 띠고 음극(-) 쪽으로 이동할 것이고, pI보다 높은 pH 영역에 있다면 음전하를 띠고 양극(+) 쪽으로 이동할 것입니다.
이렇게 이동하다가 자신의 pI 값과 정확히 동일한 pH 지점에 도달하면 알짜 전하가 0이 되어 더 이상 전기장 하에서 이동하지 않고 그 위치에 머무르게 됩니다. 이것이 바로 '등전점 집속' 현상입니다. 만약 확산에 의해 이 지점을 벗어나더라도 다시 전하를 띠게 되어 원래의 pI 위치로 되돌아가므로, 각 단백질 성분들은 매우 좁은 영역에 고농도로 농축되어 분리됩니다.
모든 단백질 성분들이 각자의 pI 위치에 집속된 후에는, 이 분리된 띠(zone)들을 검출기로 이동시켜야 합니다. 이를 동원(mobilization) 단계라고 하는데, 보통 압력을 가하거나(hydrodynamic mobilization), 완충 용액의 염 농도를 변화시켜(salt mobilization) 전체 pH 구배와 함께 집속된 단백질 띠들을 모세관 밖으로 밀어내어 검출기를 통과하도록 합니다.
cIEF는 pI 값이 미세하게 다른 단백질 이성질체(isoforms)나 변형된 단백질(modified proteins)들을 매우 높은 분해능으로 분리할 수 있다는 강력한 장점을 가지고 있습니다. 단백질의 품질 관리, 항체 의약품 분석, 단백질체학(proteomics) 연구 등에서 매우 중요하게 활용됩니다.
모세관 동위원소 이동 전기영동(Capillary Isotachophoresis, CITP)
CITP는 다른 CE 모드들과는 다소 다른 원리를 사용하는 독특한 분리 및 농축 기술입니다. "Isotachophoresis"라는 이름은 "동일한 속도(iso = same, tacho = speed)"를 의미하는데, 이는 분리된 분석물 이온들이 모두 동일한 속도로 이동하는 특징에서 유래했습니다.
CITP는 불연속적인 전해질 시스템(discontinuous electrolyte system)을 사용합니다. 즉, 모세관 내에 최소 두 가지 다른 전해질 용액을 사용하는데, 하나는 분석물 이온보다 이동성이 빠른 선행 전해질(leading electrolyte, LE)이고 다른 하나는 분석물 이온보다 이동성이 느린 종결 전해질(terminating electrolyte, TE)입니다. 선행 전해질과 종결 전해질은 분석물 이온과 동일한 부호의 전하를 가지며, 반대 전하를 띠는 공통 이온(counter-ion)을 공유합니다. 시료는 선행 전해질과 종결 전해질 사이에 주입됩니다.
여기에 전압을 가하면 어떻게 될까요? 이동성이 가장 빠른 선행 이온(L)이 맨 앞에서 이동하고, 이동성이 가장 느린 종결 이온(T)이 맨 뒤에서 이동합니다. 그 사이에는 시료 중의 분석물 이온(A, B, C...)들이 각자의 이동성 순서대로 배열됩니다. 즉, L > A > B > C > ... > T 순서로 뚜렷하게 분리된 영역(zone)들을 형성하며 이동하게 됩니다.
여기서 중요한 점은, 정상 상태(steady state)에 도달하면 이 모든 분리된 영역들이 동일한 속도로 이동한다는 것입니다. 어떻게 이동성이 다른 이온들이 같은 속도로 움직일 수 있을까요? 이는 각 영역 내의 전기장 세기(electric field strength)가 자동으로 조절되기 때문입니다. 옴의 법칙($V=IR$)과 전도도($\kappa$)를 고려하면, 전기장 세기($E$)는 전류 밀도($J$)를 전도도로 나눈 값($E = J/\kappa$)과 같습니다. 시스템 전체에 걸쳐 전류 밀도는 거의 일정하게 유지되므로, 이동성이 낮은(즉, 전도도가 낮은) 이온 영역에서는 전기장 세기가 강해지고, 이동성이 높은(전도도가 높은) 이온 영역에서는 전기장 세기가 약해집니다. 결과적으로, 각 이온의 이동 속도($v = \mu E$)는 모든 영역에서 동일하게 유지되는 것입니다 ($v_L = \mu_L E_L = v_A = \mu_A E_A = ... = v_T = \mu_T E_T$).
CITP의 또 다른 중요한 특징은 자체적인 농축 효과(self-concentration effect)가 있다는 것입니다. 각 분석물 영역의 농도는 선행 전해질의 농도와 분석물 및 선행 이온의 이동성에 의해 결정됩니다 (Kohlrausch 조절 함수). 만약 시료 내 분석물의 초기 농도가 이 평형 농도보다 낮으면, 영역 경계면에서 전기장 변화에 의해 분석물 이온들이 자동으로 농축되어 평형 농도에 도달하게 됩니다. 따라서 CITP는 미량 성분을 분석하거나 다른 분석법(예: CZE 또는 MS)의 전처리 단계로서 시료를 농축하는 데 매우 유용하게 사용될 수 있습니다.
CITP는 주로 작은 이온성 분석물(무기 이온, 유기산, 아미노산 등)의 분리 및 농축에 적용되며, 식품 분석, 환경 분석, 임상 화학 등에서 활용됩니다.
이 외에도 모세관 전기크로마토그래피(Capillary Electrochromatography, CEC)와 같이 모세관 내에 HPLC와 같은 충전물을 채우고 전기영동과 크로마토그래피 원리를 동시에 이용하는 하이브리드 기술 등 다양한 변형된 CE 모드들이 개발되어 특정 분석 목적에 맞게 활용되고 있습니다. 이처럼 CE는 다양한 모드를 통해 광범위한 종류의 분석물에 대한 맞춤형 분리 전략을 제공하는 매우 유연하고 강력한 분석 플랫폼이라고 할 수 있습니다.
모세관 전기영동법(CE)의 최적화
모세관 전기영동법으로 좋은 분리 결과를 얻기 위해서는 다양한 실험 변수들을 신중하게 고려하고 최적화하는 과정이 필수적입니다. 마치 오케스트라의 지휘자가 각 악기의 소리를 조율하여 완벽한 하모니를 만들어내듯, CE 분석가도 여러 파라미터들을 조절하여 원하는 분리 목표를 달성해야 합니다. 주요 최적화 변수들과 그 영향을 서술형으로 살펴보겠습니다.
가장 중요한 요소 중 하나는 완충 용액(Buffer / Background Electrolyte, BGE)입니다. 완충 용액의 조성은 CE 분리에 가장 큰 영향을 미칩니다. 먼저 pH는 분석물의 전하 상태와 모세관 벽의 전하 밀도(즉, EOF)를 결정하는 가장 중요한 변수입니다. 약산성 또는 약염기성 분석물의 경우, pH 변화에 따라 해리 평형이 이동하여 유효 전하(effective charge)와 전기영동 이동성이 크게 달라집니다. 따라서 분석물들의 pKa 또는 pI 값을 고려하여 최적의 분리가 이루어지는 pH를 선택해야 합니다. 또한, pH는 EOF의 속도와 방향을 조절하는 데에도 결정적인 역할을 합니다.
또한, 완충 용액의 농도(이온 강도)는 용액의 전도도와 이중 전기층 두께에 영향을 미칩니다. 농도가 높을수록 전도도가 증가하여 동일 전압에서 전류가 커지고 줄 열 발생이 증가할 수 있습니다. 또한, 이중 전기층 두께가 감소하여 EOF 속도가 느려지는 경향이 있습니다. 너무 낮은 농도는 완충 능력(buffering capacity) 부족과 피크 모양 불량을 유발할 수 있으며, 너무 높은 농도는 과도한 줄 열과 긴 분석 시간을 초래할 수 있습니다. 보통 10-100 mM 범위의 농도가 사용됩니다.
사용하는 완충 용액의 종류 역시 중요합니다. 완충 용액 이온 자체도 분석물과의 상호작용(이온 쌍 형성 등)을 통해 분리 선택성에 영향을 줄 수 있습니다. 또한, 완충 용액 이온의 이동성도 전체적인 전류와 EOF에 영향을 미칩니다. 흔히 사용되는 완충 용액으로는 인산염(phosphate), 아세트산염(acetate), 보레이트(borate), 트리스(Tris) 등이 있습니다.
그리고 완충 용액에 다양한 첨가제(Additives)를 넣어 분리능을 향상시키거나 특정 문제를 해결할 수 있습니다. 예를 들어, 유기 용매(메탄올, 아세토니트릴 등)를 첨가하면 분석물의 용해도와 EOF를 조절할 수 있습니다. 계면활성제(SDS 등)는 MEKC 모드에서 미셀을 형성하여 중성 분자를 분리하거나 단백질 흡착을 방지하는 데 사용됩니다. 키랄 선택제(사이클로덱스트린 등)는 광학 이성질체 분리에 필수적입니다. 금속 이온, 착화제, 점도 증가제 등도 특정 목적에 따라 사용될 수 있습니다.
두 번째로 고려할 변수는 인가 전압(Applied Voltage)입니다. 인가 전압은 분석물의 이동 속도와 분리 효율에 직접적인 영향을 미칩니다. 전압이 높을수록 전기장 세기가 강해져 분석물의 이동 속도가 빨라지고 분석 시간이 단축됩니다. 또한, 이론적으로 전압이 높을수록 분리 효율(N)도 증가합니다.
하지만 전압을 무작정 높일 수는 없습니다. 전압 제곱에 비례하여 줄 열(Joule heat) 발생이 증가하기 때문입니다 ($P = V^2/R$). 과도한 줄 열은 모세관 내부에 온도 구배를 유발하여 점도 변화, 확산 증가, 대류 현상 등을 일으켜 오히려 분리능을 저하시키고 재현성을 떨어뜨릴 수 있습니다. 따라서 모세관의 냉각 효율을 고려하여 줄 열 발생을 최소화하면서도 충분한 분리 효율과 분석 속도를 얻을 수 있는 최적의 전압을 선택해야 합니다. 보통 10-30 kV 범위에서 사용됩니다.
세 번째 최적화 요소는 온도(Temperature)입니다. 온도는 완충 용액의 점도, 분석물의 확산 계수, 이온 이동성, EOF 속도 등 여러 요인에 영향을 미칩니다. 온도가 상승하면 용액의 점도가 감소하여 모든 이동 속도(전기영동 및 EOF)가 빨라지고 분석 시간이 단축됩니다. 하지만 확산 계수도 증가하여 피크가 넓어질 수 있습니다. 또한, 온도는 해리 평형이나 반응 속도에도 영향을 미칠 수 있습니다. 무엇보다 재현성 있는 결과를 얻기 위해서는 분석 중 온도를 일정하게 유지하는 것이 매우 중요합니다. 대부분의 CE 장비에는 정밀한 온도 조절 시스템이 장착되어 있습니다 (보통 15-60 °C 범위).
네 번째로 모세관(Capillary)의 특성도 분리에 영향을 미칩니다. 모세관의 내경(Internal Diameter, ID)은 작을수록 열 방출 효율이 좋아져 더 높은 전압을 사용할 수 있고 분리 효율이 향상됩니다. 하지만 내경이 너무 작으면 시료 주입량이 줄어들고 검출기 감도가 낮아질 수 있으며, 막힐 위험도 커집니다. 보통 25-75 µm 범위가 널리 사용됩니다.
모세관의 길이(Length)가 길수록 분리 시간이 길어지지만, 더 많은 이론 단수를 확보하여 분리능이 향상될 수 있습니다 (단, 확산에 의한 피크 넓어짐도 증가). 총 길이(total length)와 유효 길이(effective length, 주입구에서 검출기까지)를 고려하여 분석 시간과 분리능 사이의 균형을 맞춰야 합니다.
마지막으로 모세관의 내벽 처리(Wall Coating)도 중요합니다. 용융 실리카 모세관의 내벽은 음전하를 띤 실라놀기로 인해 단백질과 같은 양전하 분석물이 흡착되기 쉽습니다. 이러한 비특이적 흡착(non-specific adsorption)은 피크 모양을 나쁘게 만들고 재현성을 저하시키며, 심지어 분석물을 완전히 잃어버리게 할 수도 있습니다. 이를 방지하기 위해 모세관 내벽을 중성 또는 소수성 폴리머 등으로 코팅하여 표면 전하를 중화시키거나 분석물과의 상호작용을 줄이는 방법을 사용합니다. 코팅은 EOF를 조절하는 데에도 사용될 수 있습니다.
다섯 번째 요소는 시료 주입(Injection) 방식과 양입니다. 시료 주입량과 주입 방식도 분리능에 영향을 미칩니다. 너무 많은 양의 시료를 주입하면 초기 시료 띠(initial sample plug)가 너무 넓어져 분리능이 저하됩니다 (과부하, overload). 따라서 분리능을 최대화하려면 가능한 한 짧은 길이의 시료 띠를 주입해야 합니다. 유체 동력학적 주입에서는 주입 압력과 시간을 조절하고, 전기 동력학적 주입에서는 주입 전압과 시간을 조절하여 최적의 주입량을 결정합니다.
또한, 시료 매트릭스(sample matrix)가 완충 용액과 크게 다를 경우 (예: 염 농도 차이), 전기적 특성 차이로 인해 피크 모양 왜곡이나 이동 시간 변화가 발생할 수 있으므로 주의해야 합니다. 경우에 따라 시료 매트릭스를 완충 용액과 유사하게 맞춰주는 전처리가 필요할 수 있습니다.
이러한 다양한 변수들은 서로 독립적이지 않고 상호 연관되어 영향을 미칩니다. 예를 들어, 완충 용액의 농도를 바꾸면 최적 전압 조건도 달라질 수 있습니다. 따라서 CE 메서드를 개발하고 최적화하는 과정은 종종 여러 변수들을 체계적으로 변화시키면서 분리능, 분석 시간, 재현성 등을 평가하는 반복적인 작업이 필요합니다. 최근에는 실험 설계법(Design of Experiments, DoE)과 같은 통계적인 방법을 활용하여 효율적으로 최적 조건을 찾는 연구도 활발히 이루어지고 있습니다.
모세관 전기영동법(CE)의 장단점
모세관 전기영동법은 여러 뛰어난 장점들을 가지고 있지만, 동시에 몇 가지 단점과 해결해야 할 과제들도 안고 있습니다. CE 기술을 올바르게 이해하고 효과적으로 활용하기 위해서는 이러한 장단점을 명확히 파악하는 것이 중요합니다.
먼저 CE의 장점을 살펴보겠습니다.
첫째, 매우 높은 분리 효율(Very High Separation Efficiency)을 들 수 있습니다. 앞서 설명했듯이, 효과적인 열 방출로 인한 높은 전압 사용과 개방형 튜브 구조 덕분에 수십만에서 수백만에 달하는 이론 단수를 달성할 수 있습니다. 이는 복잡한 혼합물 속의 미세한 차이를 가진 성분들도 효과적으로 분리할 수 있게 해줍니다.
둘째, 빠른 분석 시간(Fast Analysis Speed)입니다. 높은 전압을 사용하여 분석물의 이동 속도를 높일 수 있고, 모세관 길이가 비교적 짧기 때문에 대부분의 분리가 수 분 내에 완료됩니다. 이는 대량 시료 처리나 신속한 결과 확인이 필요한 경우 매우 유리합니다.
셋째, 극소량의 시료 및 용매 소모(Minimal Sample and Reagent Consumption)가 가능합니다. 모세관의 부피가 매우 작아 나노리터(nL) 수준의 시료만으로 분석이 가능하며, 완충 용액 소모량도 마이크로리터(µL) 수준으로 매우 적습니다. 이는 귀중한 시료를 절약하고 분석 비용 및 폐기물 발생을 줄이는 친환경적인 장점입니다.
넷째, 다양한 분리 모드(Versatile Separation Modes)를 제공합니다. CZE, MEKC, CGE, cIEF, CITP 등 다양한 모드를 통해 분석 대상 물질의 특성(전하, 크기, 소수성, pI 등)에 맞춰 최적의 분리 전략을 선택할 수 있습니다. 이는 CE의 적용 범위를 매우 넓혀줍니다.
다섯째, 자동화 용이성(Ease of Automation)이 뛰어납니다. CE 시스템은 구조가 비교적 간단하고 시료 주입부터 데이터 처리까지 전 과정의 자동화가 용이합니다. 이는 높은 처리량(high throughput)과 재현성 있는 결과를 얻는 데 기여합니다.
여섯째, 간편한 방법 개발 및 전환(Simple Method Development and Switching)이 가능합니다. 모세관과 완충 용액만 교체하면 다른 모드나 분리 조건으로 비교적 쉽게 전환할 수 있습니다. HPLC처럼 컬럼 평형화 등에 많은 시간이 소요되지 않는 경우가 많습니다.
반면에 CE의 단점 및 극복 과제는 다음과 같습니다.
첫째, 상대적으로 낮은 농도 감도(Relatively Low Concentration Sensitivity)입니다. 특히 가장 널리 사용되는 UV-Vis 흡광 검출기의 경우, 모세관의 내경이 매우 작아 광 경로(path length)가 짧기 때문에 감도가 HPLC에 비해 낮은 경향이 있습니다. 이는 미량 성분 분석에 제약이 될 수 있습니다. 이를 극복하기 위해 감도가 높은 LIF 검출기 사용, 모세관 내 광 경로를 늘리는 기술(예: Z-cell, bubble cell), 온라인 농축 기법(stacking, CITP 등) 개발, 고감도 검출기인 MS와의 결합(CE-MS) 등이 시도되고 있습니다.
둘째, 재현성 문제(Reproducibility Issues)가 발생할 수 있습니다. 이동 시간(migration time)의 재현성은 분석 결과의 신뢰도에 매우 중요합니다. 하지만 이동 시간은 EOF에 크게 의존하는데, EOF는 모세관 내벽 상태, 완충 용액 조성, 온도, 전압 등 여러 요인에 민감하게 영향을 받습니다. 특히 모세관 내벽 상태는 분석 중에도 변할 수 있어(예: 분석물 흡착), 이동 시간의 변동성(drift)을 유발할 수 있습니다. 이를 개선하기 위해 매 분석 전후 모세관 세척 프로토콜을 철저히 지키고, 내부 표준 물질(internal standard)을 사용하며, 온도와 전압을 정밀하게 제어하는 노력이 필요합니다.
셋째, 모세관 취급의 어려움 및 내구성(Capillary Handling and Durability) 문제입니다. 용융 실리카 모세관은 매우 가늘고 깨지기 쉬워 취급에 주의가 필요합니다. 또한, 반복적인 사용이나 강한 pH 조건, 특정 첨가제 등에 의해 내벽 코팅이 손상되거나 모세관 자체가 약해질 수 있습니다.
넷째, 복잡한 매트릭스 시료의 영향(Matrix Effects)을 받을 수 있습니다. 혈액, 소변, 식품 추출물과 같이 복잡한 매트릭스를 가진 시료는 매트릭스 성분들이 모세관 벽에 흡착되거나 EOF에 영향을 주어 분리능과 재현성을 저하시킬 수 있습니다. 따라서 적절한 시료 전처리(sample preparation) 과정이 중요하며, 이는 전체 분석 시간과 비용을 증가시킬 수 있습니다.
다섯째, 가장 기본적인 CZE 모드에서는 중성 분자 분리의 어려움이라는 명확한 한계가 있습니다. 물론 MEKC와 같은 다른 모드를 통해 해결할 수 있지만, 추가적인 최적화 과정이 필요합니다.
이러한 단점들에도 불구하고, CE의 독보적인 장점들 때문에 지속적인 기술 개발과 개선 노력을 통해 그 한계를 극복하고 응용 분야를 넓혀가고 있습니다. 특히, 다른 분석 기술로는 분리가 어렵거나 불가능한 문제들을 해결하는 데 있어 CE는 여전히 강력하고 매력적인 선택지입니다.
아래 표는 CE의 주요 장단점을 요약합니다.
| 장점 (Advantages) | 단점 (Disadvantages) |
|---|---|
| 높은 분리 효율 (High Efficiency) | 낮은 농도 감도 (UV) (Low Sensitivity) |
| 빠른 분석 시간 (Fast Analysis) | 이동 시간 재현성 (Migration Time Reproducibility) |
| 적은 시료/용매 소모 (Low Consumption) | 모세관 취급/내구성 (Capillary Handling/Durability) |
| 다양한 분리 모드 (Versatile Modes) | 매트릭스 효과 (Matrix Effects) |
| 자동화 용이 (Easy Automation) | 중성 분자 분리 한계 (CZE) (Neutral Separation Limit - CZE) |
| 간편한 방법 개발 (Simple Method Development) | 기술적 전문성 요구 (Requires Expertise) |
모세관 전기영동법(CE)의 응용 분야
모세관 전기영동법은 그 뛰어난 분리 능력과 다양한 모드를 바탕으로 매우 광범위한 분야에서 활용되고 있습니다. 특히, 기존의 HPLC나 겔 전기영동으로는 분석이 어렵거나 비효율적인 문제들을 해결하는 데 큰 역할을 하고 있습니다. 주요 응용 분야를 서술형으로 살펴보겠습니다.
첫 번째 주요 응용 분야는 제약 및 바이오 제약 산업(Pharmaceutical and Biopharmaceutical Industry)입니다. 이 분야에서 CE는 신약 개발부터 품질 관리(QC)에 이르기까지 제약 산업 전반에서 매우 중요하게 사용됩니다. CE는 약물 순도 분석 및 불순물 프로파일링에 활용됩니다. CZE나 MEKC를 이용하여 주성분 약물과 미량의 관련 불순물, 분해 산물 등을 고분해능으로 분리하고 정량할 수 있습니다. 특히, 전하를 띤 약물 분석에 효과적입니다.
또한, 키랄 분리(Chiral Separation)에 매우 유용합니다. 많은 약물들이 광학 이성질체(enantiomer)를 가지며, 이성질체 간에 약효나 독성이 다른 경우가 많습니다. MEKC나 CZE에 키랄 선택제(예: 사이클로덱스트린)를 첨가하여 광학 이성질체들을 효과적으로 분리하고 각 이성질체의 순도를 평가하는 데 널리 사용됩니다. 이는 규제 기관에서 요구하는 필수적인 품질 관리 항목입니다.
특히 단백질 의약품 분석에서 CE는 핵심적인 역할을 합니다. 항체 의약품, 재조합 단백질 등 바이오 의약품의 분석에 필수적입니다. cIEF는 단백질의 전하 이성질체(charge variants)를 분리하여 제품의 균일성과 안정성을 평가합니다. SDS-CGE는 단백질의 크기(분자량) 분포를 분석하여 순도(purity)와 불순물(예: 응집체, 절편)을 평가합니다. 펩타이드 맵핑(Peptide Mapping)은 단백질을 효소로 잘게 자른 후 생성된 펩타이드 조각들을 CZE나 CE-MS로 분리 분석하여 단백질의 1차 구조 확인 등에 활용합니다. 이 외에도 제형 분석(Formulation Analysis)이나 백신 분석에서도 CE는 품질 관리에 기여합니다.
두 번째로 생명 과학 및 생화학 연구(Life Science and Biochemical Research) 분야에서도 CE는 유용한 도구입니다. DNA 분석에서 CGE는 DNA 염기서열 분석, 유전자형 분석, STR 분석(법의학적 신원 확인) 등 유전체 연구의 핵심 기술입니다.
단백질 및 펩타이드 분석 분야에서는 단백질체학 연구에 활용됩니다. 단백질 발현 프로파일링, 번역 후 변형(PTM) 분석 등에 응용되며, 특히 CE-MS는 복잡한 생체 시료 분석에 강력한 성능을 보입니다. 아미노산 및 대사체 분석을 통해 대사 경로 연구(metabolomics)나 질병 진단 마커 발굴에 응용됩니다. 최근에는 단일 세포 분석(Cell Analysis)에도 CE 기술이 적용되어 세포 이질성 연구에 기여하고 있습니다.
세 번째 응용 분야는 임상 진단(Clinical Diagnostics)입니다. CE는 질병 진단 및 모니터링을 위한 임상 검사에도 활용되고 있습니다. *혈청 단백질 전기영동(Serum Protein Electrophoresis, SPE)은 *CZE를 이용하여 다발성 골수종 등의 진단에 사용됩니다. 전통적인 겔 전기영동법보다 빠르고 정량적이며 자동화에 유리합니다.
헤모글로빈 변이체 분석(Hemoglobin Variant Analysis)은 CZE나 cIEF를 이용하여 혈색소병증을 진단합니다. 소변 분석을 통해 신장 질환, 대사 이상 등을 검사할 수 있습니다. 면역 측정법(Immunoassays) 분야에서도 CE를 이용한 면역 전기영동 기법이 개발되어 특정 바이오마커 측정에 응용될 수 있습니다.
네 번째로 법의학(Forensic Science) 분야에서 CE는 범죄 수사에 필요한 증거물 분석에 중요한 역할을 합니다. DNA 프로파일링, 특히 CGE를 이용한 STR 분석은 개인 식별 및 친자 확인 등에 사용되는 표준적인 DNA 분석법입니다. 극미량의 시료에서도 정확한 유전자형 정보를 얻을 수 있습니다.
약독물 분석에도 CZE, MEKC, CE-MS 등이 활용되어 혈액, 소변 등에서 마약, 독극물 등을 검출합니다. 폭발물 및 총기 발사 잔류물 분석에도 사용될 수 있으며, 문서 위조 감정을 위한 잉크 및 섬유 분석 등 증거물 분석에도 적용될 수 있습니다.
다섯 번째는 식품 분석(Food Analysis) 분야입니다. 식품의 품질, 안전성, 진위 여부를 평가하는 데 CE가 유용하게 사용됩니다. 식품 첨가물 분석(보존료, 감미료, 착색료 등), 영양 성분 분석(비타민, 아미노산 등), 유해 물질 분석(잔류 농약, 곰팡이 독소 등)에 활용됩니다. 또한, 원산지나 품종에 따른 특정 성분 프로파일을 비교하는 식품 진위 판별(Authenticity)에도 활용될 수 있습니다.
여섯 번째 응용 분야는 환경 분석(Environmental Analysis)입니다. 물, 토양, 대기 등 환경 시료 중의 오염 물질을 분석하는 데 CE가 적용됩니다. 수질 분석에서 CZE는 무기 이온 분석에 널리 사용되며, MEKC나 CE-MS는 유기 오염 물질 분석에 활용됩니다. 토양 및 퇴적물 분석이나 대기 분석 분야에서도 중금속 이온, 유기 오염 물질, 이온 성분 분석 등에 응용될 수 있습니다.
이처럼 모세관 전기영동법은 제약, 생명 과학, 임상, 법의학, 식품, 환경 등 매우 다양한 분야에서 복잡한 혼합물을 분리하고 분석하는 강력한 도구로 자리매김하고 있습니다. 특히, 다른 분석 기술과의 상보적인 활용(예: HPLC-CE, CE-MS)을 통해 그 분석 능력과 응용 범위는 더욱 확장될 것으로 기대됩니다.
결론 모세관 전기영동법(CE)의 현재와 미래
지금까지 우리는 모세관 전기영동법(Capillary Electrophoresis, CE)의 세계를 아주 깊이 있게 탐험했습니다. 아주 가느다란 모세관 안에서 전기장의 힘을 빌려 물질들을 정교하게 분리하는 이 기술의 기본 원리부터 시작해서, 분석 장치의 구성 요소, 분석 목적에 따라 다양하게 변형되는 여러 분리 모드들(CZE, MEKC, CGE, cIEF, CITP 등), 최상의 결과를 얻기 위한 최적화 과정, 그리고 CE가 가진 빛나는 장점과 극복해야 할 과제들까지 상세하게 살펴보았습니다. 더 나아가 제약, 생명 과학, 임상 진단, 법의학, 식품, 환경 분석 등 CE가 실제로 얼마나 다채로운 분야에서 핵심적인 역할을 수행하고 있는지도 확인했습니다.
핵심을 다시 한번 요약하자면, CE는 전기영동 원리를 기반으로 하되, 모세관이라는 독특한 환경과 전기삼투 흐름(EOF)이라는 중요한 현상을 활용하여 극도로 높은 분리 효율과 빠른 분석 속도, 그리고 극미량 시료 분석이라는 강력한 장점을 제공하는 분석 기술입니다. 비록 감도나 재현성 측면에서 일부 도전 과제를 안고 있지만, 지속적인 기술 개발과 다른 분석 기술과의 융합(특히 질량분석기와의 결합, CE-MS)을 통해 이러한 한계를 극복하고 그 성능과 응용 범위를 끊임없이 확장해 나가고 있습니다.
아니, 그래서 CE가 HPLC보다 무조건 좋은 거냐?
그렇게 단정적으로 말할 수는 없습니다. CE와 HPLC는 서로 다른 분리 원리와 장단점을 가진 상보적인(complementary) 분석 기술입니다. 어떤 기술이 더 '좋다'기보다는, 분석하고자 하는 시료의 특성과 분석 목적에 따라 더 적합한 기술을 선택하는 것이 중요합니다. 예를 들어, 전하를 띤 작은 분자나 단백질 이성질체 분리, DNA 분석 등에서는 CE가 강점을 보일 수 있지만, 소수성이 매우 강한 중성 분자나 대량의 시료 정제 등에는 HPLC가 더 유리할 수 있습니다. 종종 두 기술을 함께 사용하여 시료에 대한 더 완전한 정보를 얻기도 합니다 (직교적 분석, orthogonal analysis). 중요한 것은 각 기술의 원리와 특성을 정확히 이해하고 문제 해결에 가장 효과적인 도구를 선택하고 활용하는 능력입니다.
모세관 전기영동법은 앞으로도 분석 과학 분야에서 계속해서 중요한 역할을 수행할 것입니다. 특히, 단일 세포 분석, 초고감도 분석, 현장 진단(point-of-care testing)을 위한 마이크로칩 기반 CE 시스템(Lab-on-a-Chip) 등의 분야에서 그 발전 가능성이 더욱 기대됩니다. 이 글을 통해 모세관 전기영동법에 대한 깊이 있는 이해를 얻으셨기를 바라며, 이 강력한 분석 도구가 어떻게 세상을 더 자세히 들여다보고 다양한 문제들을 해결하는 데 기여하는지 지속적인 관심을 가져주시길 바랍니다.
2025.04.13 - [분자진단] - NGS (Next Generation Sequencing)의 개념, 원리, 방법, 적용 분야
NGS (Next Generation Sequencing)의 개념, 원리, 방법, 적용 분야
이번 시간에는 현대 생명과학과 의학 연구의 패러다임을 바꾼 혁신적인 기술, 차세대 염기서열 분석(Next Generation Sequencing, NGS)에 대해 심도 있게 알아보겠습니다. 혹시 몇 년 전, 유명 할리우드
labdoctor.tistory.com
2025.04.13 - [분자진단] - SNP (Single Nucleotide Polymorphism)의 정의, 임상적 의의, 검사 방법
SNP (Single Nucleotide Polymorphism)의 정의, 임상적 의의, 검사 방법
우리 인간은 모두 같은 '사람'이라는 종에 속하지만, 놀랍도록 다채로운 모습과 특성을 지니고 살아갑니다. 쌍둥이가 아닌 이상, 세상에 외모부터 성격, 심지어 특정 질병에 걸릴 확률이나 약물
labdoctor.tistory.com
2025.04.12 - [정도관리 통계] - 내부정도관리에서 pooled CV의 계산과 적용방법
내부정도관리에서 pooled CV의 계산과 적용방법
임상검사실에서 매일 수행하는 검사 결과의 신뢰성, 어떻게 보장할 수 있을까요? 그 답의 중심에는 내부정도관리(Internal Quality Control, IQC)가 있습니다. 특히 검사 과정이 얼마나 정밀(Precise)한지,
labdoctor.tistory.com
2025.04.12 - [임상화학] - 혈장, 혈청 검체의 차이와 검사 적응증
혈장, 혈청 검체의 차이와 검사 적응증
건강검진 결과표를 받아보거나 병원에서 진료를 받을 때, 우리는 흔히 '혈액 검사'라는 말을 듣게 됩니다. 혈액 검사 결과는 우리 몸의 건강 상태를 파악하는 데 매우 중요한 정보를 제공하는데
labdoctor.tistory.com
참고문헌
- Skoog, D. A., Holler, F. J., & Crouch, S. R. (2017). Principles of Instrumental Analysis (7th ed.). Cengage Learning.
- Weinberger, R. (2000). Practical Capillary Electrophoresis (2nd ed.). Academic Press.
- Baker, D. R. (1995). Capillary Electrophoresis. Wiley-Interscience.
- Landers, J. P. (Ed.). (2008). Handbook of Capillary and Microchip Electrophoresis and Associated Microtechniques (3rd ed.). CRC Press.
- Grossman, P. D., & Colburn, J. C. (Eds.). (1992). Capillary Electrophoresis: Theory and Practice. Academic Press.
- Heiger, D. N. (2000). High Performance Capillary Electrophoresis: An Introduction. Agilent Technologies. (Application Note)
- Dovichi, N. J., & Zhang, J. Z. (2000). How capillary electrophoresis sequenced the human genome. Angewandte Chemie International Edition, 39(24), 4463-4468.
- Righetti, P. G., Gelfi, C., & Verzola, B. (2001). The state of the art of dynamic coatings in capillary electrophoresis. Electrophoresis, 22(4), 603-611.
- Lucy, C. A., MacDonald, A. M., & Gulcev, M. D. (2008). Non-aqueous capillary electrophoresis: A review. Analytica Chimica Acta, 616(1), 9-25.
- Schmitt-Kopplin, P. (Ed.). (2013). Capillary Electrophoresis-Mass Spectrometry (CE-MS): Principles and Applications. Humana Press.
#임상화학
'임상화학' 카테고리의 다른 글
| 삼투압 검사의 원리, 목적, 방법 (0) | 2025.04.22 |
|---|---|
| Cystatin C 검사의 의미와 목적 (0) | 2025.04.22 |
| 혈장, 혈청 검체의 차이와 검사 적응증 (0) | 2025.04.12 |
| Tandem Mass Spectrometry의 종류와 원리, 적용 분야 (0) | 2025.04.08 |
| Mass spectrometry의 원리와 임상 검사의 적용 (0) | 2025.04.08 |




댓글