혹시 병원에서 혈액 검사를 받으시고 나서, "IgG 항체 양성, IgM 항체 양성"이라는 결과를 받아보신 적 있으신가요? 특히 임신 중이거나 중요한 건강 상태를 확인해야 할 때 이런 결과를 받으면 덜컥 겁이 날 수 있습니다. '혹시 최근에 어떤 병에 걸린 건 아닐까?', '과거에 앓고 지나간 흔적일까?' 하고 말이지요. 실제로 많은 분들이 IgG와 IgM 항체 검사 결과만으로는 감염이 언제 일어났는지 정확히 알기 어려워 혼란스러워하십니다. 마치 범죄 현장에 남겨진 지문만으로는 범행이 언제 일어났는지 단정하기 어려운 것과 비슷하다고 할까요?
이번 시간에는 바로 이러한 감염 시점 추정의 어려움을 해결하는 데 중요한 단서를 제공하는 IgG Avidity 검사에 대해 아주 깊이 있게 파헤쳐 보겠습니다. IgG Avidity 검사는 단순히 항체의 유무나 양을 넘어, 항체가 항원에 얼마나 '찰싹' 달라붙어 있는지를 측정하는 검사인데요, 이 '결합 강도'가 감염 시기를 추정하는 데 결정적인 열쇠가 됩니다. 왜 그럴까요? 우리 몸의 면역 시스템은 시간이 지남에 따라 항원에 더 강력하게 결합하는 항체를 만들어내는 '성숙' 과정을 거치기 때문입니다. 마치 처음에는 서툴렀던 기술이 연습을 통해 점점 더 정교하고 강력해지는 것과 같다고 할 수 있습니다.

이 글에서는 IgG Avidity 검사가 무엇인지, 어떤 원리로 작동하는지, 그리고 실제 임상 현장에서 어떻게 활용되는지, 그 배경이 되는 면역학적 기초 지식부터 시작하여 아주 상세하고 깊이 있게 설명해 드릴 것입니다. 또한, 검사 결과를 해석할 때 주의해야 할 점과 한계점까지 명확하게 짚어드릴 예정이니, IgG Avidity 검사에 대해 궁금증을 가졌던 분들이라면 이번 기회에 확실하게 이해하실 수 있을 겁니다. 자, 그럼 우리 몸의 놀라운 면역 반응과 그 속에서 빛을 발하는 IgG Avidity의 세계로 함께 떠나볼까요?
면역 반응의 기초: 항체와 항원
IgG Avidity 검사를 제대로 이해하기 위해서는 먼저 우리 몸의 방어 시스템, 즉 면역 반응의 기본적인 원리와 주요 등장인물인 항원과 항체에 대해 알아야 합니다. 왜냐하면 Avidity 자체가 항원과 항체 사이의 상호작용 강도를 의미하기 때문이지요. 기본적인 개념부터 차근차근 살펴보겠습니다. 이것을 모르면 Avidity 검사의 의미를 절반도 이해하기 어렵습니다. 반드시 기초부터 탄탄히 다져야 합니다.
우리 몸의 방어 시스템, 면역
우리 몸은 외부로부터 끊임없이 침입하는 세균, 바이러스, 곰팡이와 같은 병원체들, 그리고 내부에서 발생하는 비정상적인 세포(암세포 등)로부터 스스로를 보호하는 정교하고 강력한 방어 시스템을 갖추고 있습니다. 이것이 바로 면역(Immunity)입니다. 면역 시스템이 없다면 우리는 사소한 감염에도 쉽게 목숨을 잃을 수 있을 정도로, 면역은 생명 유지에 필수적인 역할을 합니다. 사실, 우리가 매일 건강하게 살아갈 수 있는 것 자체가 면역 시스템 덕분이라고 해도 과언이 아닙니다.
면역 시스템은 크게 두 가지 방어선으로 나눌 수 있는데, 바로 선천 면역(Innate immunity)과 후천 면역(Adaptive immunity) 또는 적응 면역입니다. 선천 면역은 우리가 태어날 때부터 가지고 있는 기본적인 방어 체계입니다. 피부나 점막과 같은 물리적인 장벽, 그리고 침입자를 발견하면 즉시 공격하는 대식세포(Macrophage)나 호중구(Neutrophil)와 같은 백혈구들이 여기에 속합니다. 선천 면역은 특정 항원을 가리지 않고 즉각적으로 반응하지만, 기억 능력이 없어 같은 침입자가 다시 들어와도 동일한 방식으로만 대응한다는 특징이 있습니다. 마치 성벽과 기본적인 수비대와 같다고 할 수 있습니다.
반면에 후천 면역은 선천 면역의 방어선을 뚫고 들어온 특정 침입자, 즉 항원(Antigen)을 인식하고 그에 맞춰 특화된 공격 방법을 개발하여 대응하는 훨씬 정교한 방어 시스템입니다. 마치 적의 종류에 따라 맞춤형 무기를 개발하고 특수 부대를 훈련시키는 것과 같다고 할 수 있지요. 후천 면역의 가장 중요한 특징은 특이성(Specificity)과 기억(Memory)입니다.
즉, 특정 항원에만 반응하며, 한번 만났던 항원을 기억했다가 다시 침입하면 훨씬 빠르고 강력하게 대응합니다. 예방 접종이 효과를 발휘하는 것도 바로 이 후천 면역의 기억 능력 덕분입니다. IgG Avidity 검사는 바로 이 후천 면역 반응의 결과물인 항체의 특성을 평가하는 것이므로, 후천 면역에 대한 이해가 필수적입니다. 후천 면역은 주로 T 세포(T lymphocyte)와 B 세포(B lymphocyte)라는 림프구가 주도적인 역할을 합니다.
항원(Antigen)이란 무엇인가?
그렇다면 후천 면역 반응을 유발하는 '항원'이란 구체적으로 무엇일까요? 항원(Antigen)은 'Antibody Generator'의 줄임말로, 우리 몸의 면역 시스템, 특히 림프구(T 세포, B 세포)에 의해 '외부 침입자' 또는 '비정상적인 물질'로 인식되어 면역 반응을 유발하는 모든 물질을 의미합니다. 쉽게 말해, 우리 몸의 면역 군대가 공격 대상으로 삼는 '표적'이라고 생각하시면 됩니다.
항원의 종류는 매우 다양합니다. 세균, 바이러스, 곰팡이, 기생충과 같은 감염성 미생물의 표면 단백질이나 독소 등이 대표적인 외부 항원입니다. 또한, 꽃가루, 특정 음식물, 약물, 화학 물질 등도 알레르기 반응을 일으키는 항원(알레르겐, Allergen)이 될 수 있습니다. 심지어 우리 몸 내부에서 발생한 암세포의 변형된 단백질이나, 자가면역 질환의 경우 우리 몸 자신의 정상적인 조직 구성 성분도 항원으로 작용하여 면역 시스템의 공격을 받기도 합니다.
중요한 점은, 항체나 T 세포가 항원 전체를 통째로 인식하는 것이 아니라는 것입니다. 항원은 크기가 매우 클 수 있는데, 면역 세포는 항원 표면에 있는 특정하고 작은 부위를 인식하고 결합합니다. 이 부위를 항원 결정기(Antigenic determinant) 또는 에피토프(Epitope)라고 부릅니다. 하나의 항원 분자에는 여러 개의 서로 다른 에피토프가 존재할 수 있습니다. 마치 큰 건물(항원)의 여러 개의 창문이나 문(에피토프)을 통해 내부를 식별하는 것과 비슷합니다. 항체의 결합력(Avidity)을 이야기할 때, 실제로는 항체의 결합 부위와 항원의 이 '에피토프' 사이의 상호작용을 의미하는 것입니다. 따라서 에피토프의 개념을 이해하는 것이 중요합니다.
항체(Antibody)의 역할과 구조
이제 면역 반응의 또 다른 핵심 주역인 항체에 대해 알아볼 차례입니다. 항체(Antibody)는 면역글로불린(Immunoglobulin, Ig)이라고도 불리며, 항원이 침입했을 때 이에 대항하기 위해 후천 면역 시스템의 B 세포(정확히는 B 세포가 분화한 형질 세포, Plasma cell)에서 생성되는 Y자 모양의 단백질입니다. 항체는 혈액, 림프액, 조직액 등 체액에 존재하며, 특정 항원에 매우 특이적으로 결합하여 그 항원을 무력화시키거나 다른 면역 세포들이 항원을 쉽게 제거하도록 돕는 중요한 역할을 수행합니다. 마치 특정 표적(항원)을 추적하여 달라붙는 유도 미사일과 같다고 할 수 있습니다.
항체의 기본 구조를 살펴보면, 마치 알파벳 'Y'자와 비슷한 모양을 하고 있습니다. 이 Y자 구조는 크게 4개의 폴리펩타이드 사슬로 구성되는데, 동일한 2개의 긴 중쇄(Heavy chain)와 역시 동일한 2개의 짧은 경쇄(Light chain)가 이황화 결합(Disulfide bond)으로 연결되어 있습니다. Y자 구조는 기능적으로 두 부분으로 나눌 수 있습니다.
가변 부위(Variable region, Fab fragment)는 Y자의 양쪽 팔 끝부분에 해당하며, 아미노산 서열이 항체마다 매우 다양하게 변하는 부위입니다. 바로 이 가변 부위가 특정 항원의 에피토프를 인식하고 결합하는 부위입니다. 수많은 종류의 항원에 각각 특이적으로 결합할 수 있는 것은 바로 이 가변 부위의 다양성 덕분입니다. 하나의 항체 분자에는 2개의 동일한 항원 결합 부위(Fab)가 존재합니다. 이것이 나중에 설명할 '결합력(Avidity)' 개념에서 매우 중요하게 작용합니다. 친화력(Affinity)은 이 단일 Fab 부위와 단일 에피토프 간의 결합 강도를 의미합니다.
불변 부위(Constant region, Fc fragment)는 Y자의 줄기 부분에 해당하며, 같은 종류(Class)의 항체들 사이에서는 아미노산 서열이 비교적 일정하게 유지되는 부위입니다. 이 불변 부위는 항체가 항원에 결합한 후, 다른 면역 세포(예: 대식세포, NK 세포)나 보체(Complement) 시스템을 활성화시키는 역할을 합니다. 즉, 항원을 제거하는 실질적인 작용을 유도하는 '작동 스위치'와 같은 부분이라고 할 수 있습니다.
우리 몸에는 기능과 구조가 조금씩 다른 5가지 주요 항체 종류(Class 또는 Isotype)가 존재합니다. 이는 항체의 중쇄(Heavy chain) 불변 부위 구조 차이에 따라 결정됩니다. IgM 항체는 감염 초기에 가장 먼저 생성되는 항체입니다. 5개의 Y자 구조가 합쳐진 오량체(Pentamer) 형태를 이루고 있어 총 10개의 항원 결합 부위를 갖습니다. 따라서 개별 결합 부위의 친화력(Affinity)은 낮더라도 전체적인 결합력(Avidity)은 매우 높을 수 있습니다. 보체 활성화 능력이 뛰어납니다. 혈액 내에 주로 존재합니다.
IgG 항체는 혈액 내에서 가장 풍부하게 존재하는 항체이며, 만성 감염 단계나 2차 면역 반응 시 주된 역할을 합니다. 단량체(Monomer) 형태로 존재하며 2개의 항원 결합 부위를 갖습니다. 태반을 통과할 수 있어 모체로부터 태아에게 면역력을 전달하는 중요한 역할을 합니다. 보체 활성화, 옵소닌화(Opsonization, 항원을 대식세포가 잡아먹기 쉽게 표지하는 작용) 등 다양한 기능을 수행합니다. 오늘의 주인공인 IgG Avidity 검사는 바로 이 IgG 항체의 결합력을 측정하는 것입니다.
IgA 항체는 점막 부위(호흡기, 소화기, 비뇨생식기 등)에서 주로 발견되는 항체로, 점막을 통한 병원체 침입을 방어하는 1차 방어선 역할을 합니다. 주로 이량체(Dimer) 형태로 존재합니다. 초유에도 풍부하여 신생아의 장 건강에 기여합니다.
IgD 항체는 B 세포 표면에 주로 존재하며, B 세포의 활성화 및 분화에 관여하는 것으로 알려져 있지만, 혈청 내 농도는 매우 낮고 기능이 명확히 밝혀지지 않은 부분이 많습니다. IgE 항체는 혈청 내 농도는 매우 낮지만, 알레르기 반응과 기생충 감염에 대한 방어에 중요한 역할을 합니다. 비만 세포(Mast cell)나 호염기구(Basophil) 표면에 결합하여 있다가 알레르겐과 만나면 히스타민 등 염증 매개 물질을 분비하도록 유도합니다.
이처럼 다양한 항체들이 각자의 역할과 위치에서 우리 몸을 지키고 있으며, IgG Avidity 검사는 이 중 IgG 항체의 특성에 초점을 맞춘 검사라는 점을 기억해야 합니다.
항원-항체 반응의 기본 원리
그렇다면 항체는 어떻게 항원을 인식하고 결합할까요? 항원-항체 반응의 가장 중요한 특징은 바로 높은 특이성(Specificity)입니다. 이는 마치 자물쇠와 열쇠의 관계와 같습니다. 특정 모양의 열쇠(항체의 가변 부위)가 그에 딱 맞는 자물쇠(항원의 에피토프)에만 들어맞아 열 수 있는 것처럼, 하나의 항체는 자신에게 맞는 특정 에피토프에만 결합합니다. 이러한 특이성은 항체의 가변 부위를 구성하는 아미노산 서열의 3차원적 구조와 에피토프의 화학적, 구조적 상보성(Complementarity)에 의해 결정됩니다.
항원과 항체의 결합은 비공유 결합(Non-covalent bond)에 의해 이루어집니다. 여기에는 수소 결합, 이온 결합, 소수성 상호작용, 반데르발스 힘 등 비교적 약한 여러 종류의 화학적 결합들이 관여합니다. 개별 결합은 약하지만, 항체 결합 부위와 에피토프 사이에 여러 개의 비공유 결합이 동시에 형성되면 전체적으로는 매우 안정적이고 강력한 결합이 이루어질 수 있습니다.
이때, 항원과 항체 사이의 결합 강도를 나타내는 두 가지 중요한 개념이 등장하는데, 바로 친화력(Affinity)과 결합력(Avidity)입니다. 이 두 개념은 IgG Avidity 검사의 핵심 원리를 이해하는 데 절대적으로 중요하므로, 다음 섹션에서 아주 자세히 비교하며 설명하겠습니다. 많은 분들이 이 두 용어를 혼동하시는데, 이번 기회에 확실히 구분하셔야 합니다.
| 구분 | 정의 | 비유 예시 | 관련 항체 부위 | 특징 |
|---|---|---|---|---|
| 친화력 (Affinity) | 항체의 단일 항원 결합 부위(Fab)와 항원의 단일 에피토프 사이의 결합 강도 | 자석 하나와 철 조각 | Fab (가변 부위) | 개별 결합의 세기, 열역학적 상수(Ka)로 표현 가능 |
| 결합력 (Avidity) | 다가(Multivalent) 항체 전체와 다가 항원 전체 사이의 총체적인 결합 강도 | 벨크로, 여러 자석과 철판 | 항체 전체 | 여러 결합 부위의 시너지 효과, 기능적 결합 강도 |
표 1. 친화력(Affinity)과 결합력(Avidity) 비교
이제 면역 반응의 기초와 항원, 항체의 기본 개념을 살펴보았으니, 본격적으로 IgG Avidity의 핵심인 '결합력'에 대해 더 깊이 알아볼 준비가 되었습니다.
항체 결합력: 친화력(Affinity) vs 결합력(Avidity)
앞서 항원-항체 반응의 결합 강도를 나타내는 두 가지 중요한 개념으로 친화력(Affinity)과 결합력(Avidity)을 언급했습니다. 이 둘은 비슷해 보이지만 분명히 다른 의미를 가지며, 특히 IgG Avidity 검사의 원리를 이해하기 위해서는 그 차이를 명확히 아는 것이 극도로 중요합니다. 왜냐하면 Avidity 검사는 바로 이 'Avidity'라는 특성을 측정하는 것이기 때문입니다. 자, 그럼 친화력과 결합력이 각각 무엇을 의미하는지, 그리고 어떤 차이가 있는지 자세히 파헤쳐 보겠습니다.
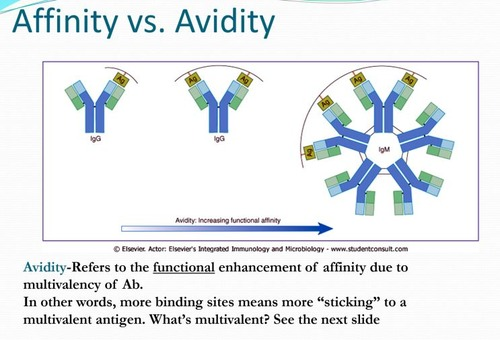
친화력(Affinity)이란 무엇인가?
친화력(Affinity)은 항체의 단 하나의 항원 결합 부위(즉, 하나의 Fab fragment)와 항원 표면에 있는 단 하나의 에피토프 사이의 결합 세기를 의미합니다. 이것은 가장 기본적인 수준에서의 결합 강도를 나타내는 척도라고 할 수 있습니다. 쉽게 말해, 1대 1 상호작용의 강도를 측정하는 것입니다.
비유를 들어 설명해 볼까요? 친화력은 마치 자석 하나가 작은 철 조각 하나에 얼마나 세게 달라붙는가와 비슷합니다. 자석의 세기(친화력)가 강할수록 철 조각을 더 단단히 붙잡고 있겠지요. 화학적으로는 평형 상태에서 항원-항체 복합체가 형성되는 경향을 나타내는 결합 상수(Association constant, Ka) 또는 해리되는 경향을 나타내는 해리 상수(Dissociation constant, Kd)로 정량화할 수 있습니다. 높은 친화력은 높은 Ka 값 또는 낮은 Kd 값을 의미하며, 이는 항체와 항원이 더 안정적으로 결합함을 나타냅니다.
친화력은 개별적인 결합 상호작용 그 자체의 강도를 나타내는 중요한 지표입니다. 하지만 실제 생체 내에서 항체는 단순히 1대 1로만 작용하는 것이 아니라, 여러 개의 결합 부위를 통해 항원과 상호작용하는 경우가 많습니다. 여기서 바로 '결합력(Avidity)'이라는 개념이 등장합니다.
결합력(Avidity)이란 무엇인가? (핵심 개념)
결합력(Avidity)은 친화력보다 좀 더 복잡하고 현실적인 개념입니다. 이것은 하나의 항체 분자 전체(즉, 여러 개의 항원 결합 부위를 가진)가 표면에 여러 개의 에피토프를 가진 항원과 상호작용할 때 나타나는 총체적인, 즉 전체적인 결합 강도를 의미합니다. 친화력이 '점'과 '점' 사이의 결합 강도라면, 결합력은 '면'과 '면' 사이의 종합적인 부착력이라고 할 수 있습니다.
"아니, 그냥 친화력 여러 개 합친 게 결합력 아니야? 뭐가 그렇게 다른 건데?"
라고 생각하실 수도 있습니다. 하지만 결합력은 단순히 개별 친화력의 산술적인 합 그 이상입니다. 결합력에는 여러 결합 부위가 동시에 작용함으로써 발생하는 엄청난 시너지 효과가 포함됩니다.
가장 흔히 사용되는 비유가 바로 벨크로(Velcro)입니다. 벨크로는 수많은 작은 갈고리(hook)와 고리(loop)로 이루어져 있지요. 갈고리 하나와 고리 하나의 결합력(친화력)은 매우 약해서 쉽게 떨어집니다. 하지만 수많은 갈고리와 고리가 동시에 달라붙으면(결합력), 엄청나게 강한 부착력을 발휘하여 떼어내기 어렵게 됩니다. 이것이 바로 Avidity의 핵심 원리입니다.
또 다른 비유로는 여러 개의 자석을 생각해 볼 수 있습니다. 자석 하나(친화력)가 철판에 붙는 힘은 그리 강하지 않을 수 있습니다. 하지만 여러 개의 자석을 철판의 여러 지점에 동시에 붙이면(결합력), 전체적으로는 훨씬 더 강하게 철판에 고정됩니다. 설령 자석 하나의 결합이 잠시 끊어지더라도 다른 자석들이 여전히 붙어 있기 때문에 전체적인 결합이 유지될 가능성이 높습니다.
IgG 항체는 Y자 구조의 양팔 끝에 총 2개의 항원 결합 부위(Fab)를 가지고 있습니다. 따라서 IgG 항체 하나가 표면에 동일한 에피토프를 여러 개 가진 항원(예: 바이러스 표면 단백질)에 결합할 때, 두 개의 Fab 부위가 동시에 또는 순차적으로 에피토프에 결합할 수 있습니다. 이렇게 되면, 설령 한쪽 Fab의 결합이 일시적으로 약해지거나 떨어지더라도 다른 쪽 Fab이 여전히 결합을 유지하고 있기 때문에, 전체적으로 항체가 항원으로부터 완전히 떨어져 나갈 확률이 크게 줄어듭니다. 즉, 개별 Fab의 친화력(Affinity)은 동일하더라도, 두 개의 결합 부위가 함께 작용함으로써 나타나는 총체적인 결합력(Avidity)은 훨씬 더 강해지는 것입니다.
참고로, 감염 초기에 주로 생성되는 IgM 항체는 5개의 Y자 단위가 모인 오량체(pentamer) 구조로, 무려 10개의 항원 결합 부위를 갖습니다. 따라서 IgM은 개별 결합 부위의 친화력이 낮더라도, 10개의 부위가 동시에 작용하여 매우 높은 결합력(High Avidity)을 나타낼 수 있습니다. 이는 감염 초기에 아직 면역 시스템이 '성숙'되지 않아 고친화력 항체를 만들지 못하더라도, 일단 침입한 항원을 효과적으로 붙잡아 두는 데 유리하게 작용합니다.
결론적으로, Avidity는 여러 개의 결합 상호작용이 동시에 일어나면서 발생하는 '협력 효과' 또는 '보너스 효과'를 포함하는 개념이며, 항체가 생체 내에서 실제로 항원을 얼마나 효과적으로 붙잡고 제거하는지를 더 잘 반영하는 기능적인 결합 강도라고 할 수 있습니다.
왜 Avidity가 중요한가? 감염 시기 추정의 단서
그렇다면 왜 IgG 항체의 'Avidity'를 측정하는 것이 감염 시기를 추정하는 데 도움이 될까요? 그 이유는 바로 앞서 잠깐 언급했던 항체 성숙(Antibody Maturation) 과정 때문입니다. 우리 몸의 면역 시스템은 항원을 처음 만나면 일단 급하게 항체를 만들어 대응하지만, 시간이 지나면서 점점 더 '업그레이드된' 항체를 만들어냅니다.
초기 감염 단계에서는 B 세포가 아직 항원에 대해 충분히 학습하지 못한 상태입니다. 이때 생성되는 IgG 항체들은 항원에 결합하기는 하지만, 그 결합 부위(Fab)와 항원의 에피토프 사이의 친화력(Affinity)이 상대적으로 낮습니다. 따라서 이 초기 IgG 항체들이 여러 개 모여 작용하는 결합력(Avidity) 역시 낮은 상태(Low Avidity)입니다. 마치 처음 만난 자물쇠에 맞는 열쇠를 급하게 만들다 보니 모양이 완벽하지 않아 뻑뻑하게 돌아가는 것과 비슷합니다.
하지만 감염이 지속되거나 동일한 항원에 다시 노출되면, B 세포는 림프절의 배중심(Germinal center)이라는 곳에서 특별한 '훈련 과정'을 거칩니다. 이 과정에는 앞서 설명한 체세포 과변이(Somatic Hypermutation, SHM)와 친화력 기반 클론 선택(Affinity-based Clonal Selection)이 포함됩니다. SHM을 통해 B 세포는 항체 유전자에 무작위적인 돌연변이를 일으켜 다양한 친화력을 가진 항체를 시험적으로 만들어냅니다. 그리고 클론 선택 과정을 통해, 이들 중 항원에 가장 강력하게 결합하는(즉, 높은 친화력을 가진) 항체를 만드는 B 세포만이 살아남아 증식하도록 선택됩니다. 마치 수많은 열쇠 디자인 중에서 자물쇠에 가장 잘 맞는 '명품 열쇠'를 골라내는 과정과 같습니다.
이러한 항체 성숙 과정을 거치면서, 감염 후 시간이 수 주에서 수 개월 정도 경과하면 우리 몸에는 점차적으로 높은 친화력(High Affinity)을 가진 IgG 항체를 생산하는 B 세포들이 주류를 이루게 됩니다. 개별 결합 부위의 친화력이 높아지면, 당연히 이들이 함께 작용할 때 나타나는 총체적인 결합력(Avidity)도 매우 높아집니다(High Avidity). 이제는 자물쇠에 완벽하게 들어맞아 부드럽게 돌아가는 '맞춤 제작 열쇠'가 만들어진 셈입니다.
바로 이 점이 IgG Avidity 검사의 핵심 원리입니다! 즉, 환자의 혈액에서 검출된 IgG 항체의 Avidity(결합력)를 측정함으로써, 이 항체가 최근 감염 시기에 주로 만들어진 것인지 (Low Avidity), 아니면 감염된 지 상당한 시간이 경과한 후 (High Avidity)에 만들어진 것인지를 간접적으로 추정할 수 있게 해줍니다. 이것은 마치 고고학자가 유물의 제작 기법이나 재질을 분석하여 그것이 어느 시대에 만들어졌는지 추정하는 것과 유사한 원리라고 할 수 있습니다. 따라서 IgG Avidity 검사는 감염 시점 판별이 중요한 임상 상황에서 매우 유용한 정보를 제공하는 것입니다.
IgG Avidity 검사: 원리와 방법
이제 IgG Avidity가 감염 시기 추정에 왜 중요한지를 이해했으니, 실제로 이 Avidity를 어떻게 측정하는지 그 검사 원리와 구체적인 방법에 대해 자세히 알아볼 차례입니다. IgG Avidity 검사는 생각보다 아주 기발한 아이디어를 기반으로 작동합니다. 바로 결합력이 약한 항체와 강한 항체의 '분리 저항성' 차이를 이용하는 것입니다.
검사의 기본 원리: 결합력 차이 이용
IgG Avidity 검사의 핵심 아이디어는 이것입니다: 결합력이 낮은 (Low Avidity) 항체는 항원과의 결합이 상대적으로 약하기 때문에, 특정 화학 물질(변성제) 처리에 의해 항원으로부터 쉽게 떨어져 나갑니다. 반면에, 결합력이 높은 (High Avidity) 항체는 항원과 매우 강하게 결합하고 있기 때문에, 동일한 변성제 처리에도 잘 떨어지지 않고 항원에 붙어 있습니다. 마치 벨크로에서 약하게 붙은 부분은 살짝만 힘을 줘도 떨어지지만, 강하게 붙은 부분은 꽤 큰 힘을 줘야 떨어지는 것과 같은 원리입니다.
이 원리를 이용하여, 환자 혈청 내 IgG 항체를 항원에 결합시킨 후, 변성제(Denaturing agent)라는 특수한 화학 물질을 처리하여 Low Avidity 항체와 High Avidity 항체를 분리해내는 것입니다. 변성제는 단백질의 3차 구조를 변화시키거나 항원-항체 간의 비공유 결합(수소 결합, 이온 결합, 소수성 상호작용 등)을 약화시키는 역할을 합니다. 주로 사용되는 변성제로는 요소(Urea), 구아니딘 염산염(Guanidine hydrochloride), 디에틸아민(Diethylamine, DEA) 등이 있으며, 특정 농도(예: 6M Urea)로 사용됩니다.
변성제 처리 후 남아있는 IgG의 양을 측정하면, 원래 존재했던 총 IgG 중에서 얼마나 많은 비율이 High Avidity 항체였는지를 알 수 있습니다. 만약 변성제 처리 후 IgG가 거의 남아있지 않다면 Low Avidity 항체가 대부분이었다는 의미이고, 반대로 많은 IgG가 남아있다면 High Avidity 항체가 많았다는 의미가 됩니다. 이것이 바로 IgG Avidity 검사의 기본적인 작동 방식입니다. 정말 간단하면서도 효과적인 방법이지요?
IgG Avidity 검사 과정 (ELISA 기반)
실제 임상 검사실에서 IgG Avidity 검사는 주로 효소면역측정법(Enzyme-Linked Immunosorbent Assay, ELISA)이라는 매우 일반적이고 널리 사용되는 면역 검사 플랫폼을 기반으로 수행됩니다. ELISA는 항원-항체 반응을 이용하여 특정 항원이나 항체를 검출하고 정량하는 방법으로, 민감도가 높고 비교적 간편하게 수행할 수 있다는 장점이 있습니다. IgG Avidity 검사를 위한 ELISA 과정은 다음과 같은 단계로 이루어집니다.
검사는 일반적으로 효소면역측정법(ELISA) 플랫폼을 기반으로 수행됩니다. 첫 번째 단계는 항원 코팅(Antigen Coating)으로, 검사용 마이크로플레이트(Microplate)의 각 웰(Well, 작은 구멍) 표면에 타겟 항원(예: 톡소플라스마 항원, CMV 항원 등)을 고정시키는 과정입니다. 항원이 웰 표면에 단단히 부착되어 있어야 이후 단계에서 항체와 반응하고 세척 과정에서도 떨어져 나가지 않습니다.
다음 단계는 검체(혈청) 반응(Sample Incubation)입니다. 환자로부터 채취한 혈액에서 분리한 혈청(Serum)을 적절히 희석하여 항원이 코팅된 웰에 넣고 일정 시간 동안 반응시킵니다. 만약 환자 혈청 내에 해당 항원에 대한 IgG 항체가 존재한다면, 이 항체들이 웰 표면의 항원에 결합하게 됩니다.
이제 Avidity를 구분하는 결정적인 단계인 변성제 처리 단계가 이어집니다. 동일한 환자 검체를 두 그룹의 웰에 나누어 처리합니다. 한 그룹(변성제 처리군)에는 특정 농도의 변성제(Denaturing agent) 용액(예: 6M Urea)을 넣고 짧은 시간 동안 반응시킵니다. 이 과정에서 항원에 약하게 결합하고 있던 Low Avidity IgG 항체는 변성제의 작용으로 인해 항원으로부터 떨어져 나가게 됩니다. 하지만 High Avidity IgG 항체는 결합력이 강하기 때문에 변성제 처리에도 여전히 항원에 붙어 있습니다. 다른 그룹(대조군)에는 변성제 대신 일반적인 세척액(예: PBS-Tween buffer)을 사용하여 동일하게 처리합니다. 이 웰에서는 변성 효과가 없으므로, 혈청 내에 존재했던 모든 IgG 항체(Low Avidity + High Avidity)가 항원에 결합된 상태를 유지하게 됩니다. 이 그룹은 변성제 처리 효과를 비교하기 위한 기준선 역할을 합니다.
각 웰을 세척액으로 여러 번 헹구어 줍니다. 이 과정을 통해 항원에 결합하지 않은 혈청 내 다른 단백질이나 물질들, 그리고 변성제 처리로 인해 떨어져 나간 Low Avidity IgG 항체들이 제거됩니다. 이제 웰에는 항원에 결합된 IgG 항체만 남게 됩니다. 변성제를 처리한 웰에는 주로 High Avidity IgG가, 처리하지 않은 웰에는 Low와 High Avidity IgG 모두가 남아 있게 됩니다.
이제 웰에 얼마나 많은 IgG 항체가 남아있는지를 측정해야 합니다. 이를 위해 효소(Enzyme, 예: HRP - Horseradish Peroxidase)가 표지된 항-인간 IgG 항체(Enzyme-conjugated anti-human IgG antibody)를 웰에 넣고 반응시킵니다. 이 2차 항체는 웰 표면의 항원에 결합되어 있는 인간 IgG 항체(1차 항체)에 특이적으로 결합합니다. 즉, 웰에 남아있는 IgG 항체가 많을수록 더 많은 효소 표지 2차 항체가 결합하게 됩니다.
2차 항체에 표지된 효소의 기질(Substrate) 용액을 웰에 첨가합니다. 기질은 효소와 반응하여 색깔을 띠는 생성물로 변환됩니다. 따라서 웰에 결합된 효소의 양(즉, 남아있는 1차 IgG 항체의 양)이 많을수록 더 진한 색깔로 발색됩니다. 발색 반응은 일정 시간 동안 진행됩니다.
마지막으로, 분광 광도계(Spectrophotometer) 또는 ELISA 판독기(ELISA reader)라는 장비를 사용하여 각 웰의 흡광도(Optical Density, OD)를 특정 파장에서 측정합니다. 흡광도 값은 웰의 색깔 농도에 비례하며, 이는 결국 각 웰에 남아있는 IgG 항체의 양을 반영합니다. 이러한 일련의 과정을 거쳐, 변성제를 처리한 웰의 흡광도 값과 변성제를 처리하지 않은 웰의 흡광도 값을 얻게 됩니다. 이제 이 두 값을 이용하여 Avidity Index를 계산할 수 있습니다.
Avidity Index (AI) 계산 및 해석
IgG Avidity 검사의 최종 결과는 보통 Avidity Index (AI) 또는 Relative Avidity Index (RAI)라는 백분율(%) 값으로 보고됩니다. 이 값은 변성제 처리 후에도 항원에 남아있는 IgG 항체의 비율을 나타냅니다. 계산 공식은 다음과 같이 매우 간단합니다.
Avidity Index (AI) = (변성제 처리 웰의 평균 흡광도 / 변성제 미처리 웰(대조군)의 평균 흡광도) x 100 (%)
예를 들어, 변성제를 처리한 웰의 평균 흡광도(OD)가 0.3이고, 처리하지 않은 대조군 웰의 평균 흡광도가 1.0이라면, Avidity Index는 (0.3 / 1.0) x 100 = 30%가 됩니다.
이제 이 계산된 Avidity Index (AI) 값을 어떻게 해석해야 할까요? 해석은 미리 정해진 기준값(Cut-off value)과 비교하여 이루어집니다. 일반적으로 AI 값을 기준으로 다음과 같이 크게 세 가지 범주로 나눕니다.
Low Avidity Index (낮은 AI 값)는, 예를 들어 AI가 30% 미만 또는 40% 미만일 경우 (기준값은 검사 키트나 연구마다 다를 수 있습니다). 이는 변성제 처리 시 대부분의 IgG 항체가 항원으로부터 떨어져 나갔음을 의미합니다. 즉, 환자의 혈청에는 결합력이 약한 Low Avidity IgG 항체가 주로 존재한다는 뜻입니다. 이것은 일반적으로 최근의 급성 1차 감염(Recent primary infection)을 강력하게 시사합니다. 대략 감염 후 3~4개월 이내에 해당될 가능성이 높습니다.
High Avidity Index (높은 AI 값)는, 예를 들어 AI가 50% 초과 또는 60% 초과일 경우. 이는 변성제 처리 후에도 상당량의 IgG 항체가 항원에 강하게 결합된 채 남아있음을 의미합니다. 즉, 환자의 혈청에는 결합력이 강한 High Avidity IgG 항체가 주로 존재한다는 뜻입니다. 이것은 일반적으로 과거 감염(Past infection)을 시사합니다. 대략 감염 후 4~6개월 이상 경과했을 가능성이 높습니다. 또는, 드물게는 재감염(Reinfection)이나 잠복 감염의 재활성화(Reactivation) 시에도 High Avidity IgG가 나타날 수 있습니다. 중요한 점은, High Avidity 결과는 최근의 급성 1차 감염 가능성을 거의 배제할 수 있다는 것입니다.
Intermediate / Borderline / Equivocal Avidity Index (중간 AI 값)는 Low Avidity와 High Avidity 기준값 사이에 해당하는 AI 값 (예: 30% ~ 50% 또는 40% ~ 60%)입니다. 이 경우는 해석이 다소 불분명합니다. 최근 감염에서 과거 감염으로 이행하는 과도기일 수도 있고, 개인의 면역 반응 특성상 Avidity 성숙이 느리거나 불완전한 경우일 수도 있습니다. 따라서 결론을 내리기 어려우며, 임상 경과를 관찰하면서 수 주 후에 재검사하여 Avidity Index의 변화 양상(증가하는지 여부)을 확인하거나, 다른 검사(예: PCR을 통한 병원체 직접 검출) 결과를 참고하여 종합적으로 판단해야 합니다. 절대로 중간값 결과 하나만으로 성급한 결정을 내려서는 안 됩니다.
여기서 반드시 명심해야 할 점이 있습니다! Low/Intermediate/High Avidity를 구분하는 기준값(Cut-off value)은 절대로 모든 검사에 동일하게 적용되지 않습니다. 이 기준값은 사용하는 검사 키트 제조사, 측정 대상 질환(병원체), 사용된 항원의 종류와 순도, 변성제의 종류와 농도, 반응 시간 등 다양한 요인에 따라 달라질 수 있습니다. 따라서 각 검사실은 사용하는 검사법에 대한 자체적인 검증(Validation)을 통해 적절한 기준값을 설정하거나, 공신력 있는 제조사의 권장 기준값 및 관련 가이드라인(예: Clinical and Laboratory Standards Institute, CLSI)을 따라야 합니다. 결과 보고서에는 사용된 기준값이 명시되어야 하며, 해석 시 이를 반드시 확인해야 합니다.
검사 결과에 영향을 미치는 요인들
IgG Avidity 검사 결과의 정확성과 신뢰성은 여러 요인에 의해 영향을 받을 수 있습니다. 따라서 검사를 수행하고 결과를 해석할 때는 이러한 잠재적 변수들을 고려하는 것이 중요합니다.
변성제 관련 요인으로, 사용되는 변성제의 종류(Urea, Guanidine 등), 농도, 그리고 처리 시간은 Avidity Index 계산에 직접적인 영향을 미칩니다. 농도가 너무 높거나 처리 시간이 길면 High Avidity 항체까지 떨어져 나갈 수 있고, 반대로 너무 약하면 Low Avidity 항체가 충분히 제거되지 않을 수 있습니다. 따라서 최적화된 조건을 일정하게 유지하는 것이 매우 중요합니다.
항원 관련 요인 역시 결과에 영향을 줄 수 있습니다. ELISA 플레이트에 코팅되는 항원의 종류, 순도, 입체 구조, 그리고 코팅 농도 역시 결과에 영향을 줄 수 있습니다. 항원의 품질이 낮거나 변성되었다면 항체 결합 자체가 불안정해져 Avidity 측정의 정확도가 떨어질 수 있습니다.
검체 관련 요인으로는 환자의 혈청 검체 보관 상태(반복적인 냉동-해동은 피해야 하며), 희석 배수, 혈청 내에 존재할 수 있는 방해 물질(예: 류마티스 인자) 등도 결과에 영향을 미칠 수 있습니다.
검사 환경 및 절차에 관련된 기술적인 요인들도 결과의 재현성과 정확성에 영향을 미칩니다. ELISA 반응 온도, 각 단계별 반응 시간, 세척 효율성, 사용되는 시약의 유효 기간 및 보관 상태 등 검사 과정 전반의 기술적인 요인들이 결과의 재현성과 정확성에 영향을 미칩니다. 검사실의 엄격한 질 관리(Quality Control, QC)가 필수적입니다.
가장 통제하기 어려운 요인으로, 개인 간의 면역 반응 차이가 있습니다. 사람마다 면역 시스템의 상태(예: 면역 저하 환자), 감염된 병원체의 종류와 항원 특성, 감염 경로, 감염 당시의 항원량, 그리고 유전적인 요인 등 다양한 변수에 의해 영향을 받습니다.
이러한 요인들 때문에 IgG Avidity 검사 결과는 항상 신중하게 해석되어야 하며, 다른 임상 정보 및 검사 결과들과 종합하여 판단하는 것이 절대적으로 필요합니다.
이제 IgG Avidity 검사의 원리와 방법에 대해 상세히 알아보았으니, 다음으로는 이 검사가 실제 임상 현장에서 어떻게 활용되고 있는지 구체적인 적용 사례들을 중심으로 살펴보겠습니다. 특히 감염 시기 추정이 중요한 상황에서 Avidity 검사가 어떤 가치를 가지는지 확인해 보시죠.
IgG Avidity 검사의 임상적 적용
IgG Avidity 검사는 그 원리상 감염 시기를 추정하는 데 매우 유용한 도구입니다. 따라서 임상 현장에서는 특히 급성 감염과 과거 감염의 감별이 중요하거나, 감염 시점에 따라 환자 관리 및 치료 방침이 달라지는 경우에 활발하게 활용되고 있습니다. 가장 대표적인 적용 분야는 역시 감염 시기 추정, 특히 임신 중 특정 감염(TORCH)의 진단입니다.
감염 시기 추정: 가장 중요한 적용 분야
가장 흔하고 중요한 IgG Avidity 검사의 활용 목적은 바로 '언제 감염되었는가?'를 알아내는 것입니다. 많은 감염성 질환에서 초기 진단을 위해 IgG 항체와 IgM 항체를 동시에 검사합니다. 일반적으로 IgM 항체는 감염 초기에 나타나 수 주에서 수 개월 지속되다가 사라지고, IgG 항체는 IgM보다 약간 늦게 나타나 장기간, 때로는 평생 지속되는 경향을 보입니다.
이론적으로는 IgG와 IgM이 모두 음성인 경우 감염 증거가 없다고(Non-immune) 해석할 수 있습니다. IgG는 음성이고 IgM만 양성인 경우, 아직 IgG가 생성되기 전의 극초기 감염이거나 IgM 위양성일 가능성을 고려해야 합니다. IgG와 IgM이 모두 양성이라면, 최근 급성 감염일 가능성이 있습니다. IgG는 양성이고 IgM이 음성이라면, 일반적으로 과거 감염으로 해석합니다.
하지만 실제 임상에서는 이렇게 간단하지 않은 경우가 많습니다. 이는 여러 가지 요인 때문입니다. IgM 항체의 지속 기간이 질병이나 개인에 따라 매우 다양하여, 감염 후 수개월 이상, 심지어 1년 이상 지속되는 경우(Persistent IgM)도 있기 때문입니다. 이 경우 IgG (+), IgM (+) 결과가 나왔더라도 실제로는 과거 감염일 수 있습니다. 또한, IgM 검사 자체의 위양성(False positive) 가능성도 존재합니다. 다른 감염이나 자가면역질환 등에 의해 비특이적으로 IgM이 양성으로 나올 수 있습니다.
재감염(Reinfection)이나 잠복 바이러스의 재활성화(Reactivation) 시에도 IgM이 다시 나타날 수 있습니다. 이러한 경우에도 IgG와 IgM이 동시에 양성으로 나타나 감염 시기 해석에 혼란을 줄 수 있습니다.
바로 이러한 애매한 상황, 즉 IgG 항체와 IgM 항체가 동시에 양성으로 나왔을 때, 이것이 정말로 최근에 발생한 급성 1차 감염(Primary infection)인지, 아니면 과거 감염 상태에서 IgM만 지속되거나 비특이적으로 나타난 것인지를 감별하는 데 IgG Avidity 검사가 결정적인 역할을 할 수 있습니다.
만약 IgG와 IgM이 모두 양성이면서 IgG Avidity가 낮게 (Low Avidity) 측정된다면, 이는 최근(대략 3-4개월 이내)에 발생한 급성 1차 감염(Recent Primary Infection)일 가능성이 매우 높습니다. 왜냐하면 Low Avidity IgG는 항체 성숙 과정 초기에 주로 생성되기 때문입니다.
반대로 IgG와 IgM이 모두 양성이면서 IgG Avidity가 높게 (High Avidity) 측정된다면, 이는 과거 감염(대략 4-6개월 이전)일 가능성이 매우 높습니다. 이 경우 IgM 양성은 지속적인 IgM이거나 비특이적 반응, 또는 재감염/재활성화 등을 고려해야 합니다. 중요한 점은, High Avidity 결과는 최근의 급성 1차 감염 가능성을 거의 배제할 수 있다는 것입니다.
이러한 원리를 표로 정리하면 다음과 같습니다.
| IgG 결과 | IgM 결과 | IgG Avidity 결과 | 감염 시기 해석 |
|---|---|---|---|
| 음성 (-) | 음성 (-) | 검사 안 함 (N/A) | 감염 증거 없음 (Non-immune) |
| 음성 (-) | 양성 (+) | 검사 안 함 (N/A) | 극초기 감염 가능성 (IgG 생성 전) 또는 IgM 위양성 가능성 |
| 양성 (+) | 양성 (+) | 낮음 (Low) | 최근 급성 1차 감염 (Recent Primary Infection) 강력 시사 |
| 양성 (+) | 양성 (+) | 높음 (High) | 과거 감염 (Past Infection) 강력 시사. IgM 양성은 지속적/비특이적 반응 또는 재감염/재활성화 가능성. 최근 1차 감염 배제. |
| 양성 (+) | 음성 (-) | 높음 (High) | 과거 감염 (Past Infection) |
| 양성 (+) | 음성 (-) | 낮음 (Low) | 드물지만 가능성 있음 (IgM이 먼저 소실되고 Avidity 성숙이 지연되는 경우). 해석 주의. |
| 양성 (+) | 양성 (+) | 중간 (Intermediate) | 해석 불분명. 과도기 가능성. 추적 검사 또는 다른 검사 결과 필요. |
표 2. IgG/IgM 항체 결과와 IgG Avidity 결과를 종합한 감염 시기 추정 해석
이 표에서 보듯이, 특히 IgG와 IgM이 모두 양성일 때 IgG Avidity 검사의 가치가 극대화됩니다. Avidity 결과는 임상의사가 환자의 상태를 정확히 파악하고 적절한 조치를 취하는 데 결정적인 단서를 제공할 수 있습니다.
임신 중 감염 진단 (TORCH 감염)

IgG Avidity 검사가 가장 중요하게 활용되는 분야 중 하나는 바로 임신 중 특정 감염, 일명 TORCH 감염의 진단입니다. TORCH는 선천성 감염을 유발하여 태아에게 심각한 기형이나 발달 장애를 일으킬 수 있는 대표적인 감염성 질환들의 약자입니다. 여기에는 톡소플라스마증(Toxoplasmosis), 풍진(Rubella), 거대세포바이러스(CMV), 단순포진바이러스(HSV, 단순포진바이러스), 그리고 기타(Others) 감염(매독(Syphilis), 수두(Varicella-zoster), 파보바이러스 B19 등)이 포함됩니다.
이러한 TORCH 감염들은 임신부가 임신 기간 중에 처음으로 감염(급성 1차 감염, Primary infection)되었을 때 태반을 통해 태아에게 바이러스나 기생충이 전달될 위험이 가장 높습니다. 만약 임신 전에 이미 감염되어 면역력(주로 High Avidity IgG 항체)을 가지고 있는 상태라면, 재감염이나 재활성화가 일어나더라도 태아에게 심각한 영향을 미칠 위험은 1차 감염에 비해 훨씬 낮습니다. 따라서 임신 초기 검사 등에서 TORCH 관련 IgG와 IgM 항체가 동시에 양성으로 나온 경우, 이것이 임신 중에 발생한 위험한 1차 감염인지, 아니면 임신 전에 이미 감염되었던 과거 감염의 흔적인지를 구별하는 것이 태아의 예후 예측 및 산전 관리 결정에 매우 중요합니다. 바로 이때 IgG Avidity 검사가 강력한 힘을 발휘합니다.
톡소플라스마증(Toxoplasmosis)은 고양이 분변이나 덜 익힌 육류 섭취를 통해 감염되는 기생충 질환입니다. 임신 초기에 1차 감염되면 태아에게 뇌수종, 맥락망막염, 간질 등 심각한 후유증을 유발할 수 있습니다. 임신 중 검사에서 톡소플라스마 IgG/IgM 동시 양성이 확인되면, IgG Avidity 검사를 시행합니다.
Low Avidity 결과는 임신 중 발생했을 가능성이 높은 급성 1차 감염을 시사하며, 태아 감염 위험이 높으므로 추가적인 정밀 검사(양수 PCR 등) 및 예방적 항생제 치료 등을 고려해야 합니다.
High Avidity 결과는 임신 전(적어도 4개월 이전에) 감염되었을 가능성이 매우 높음을 시사하며, 이 경우 태아에게 위험한 선천성 톡소플라스마증이 발생할 위험은 거의 없으므로 산모를 안심시킬 수 있습니다.
거대세포바이러스(Cytomegalovirus, CMV)는 가장 흔한 선천성 감염의 원인이며, 감염된 신생아의 약 10-15%에서 청력 손실, 시력 문제, 발달 지연 등의 장기적인 후유증이 나타날 수 있습니다. 톡소플라스마증과 마찬가지로 임신 중 1차 감염이 가장 위험합니다. 임신부에서 CMV IgG/IgM 동시 양성 시 CMV IgG Avidity 검사가 감염 시기 추정에 중요한 도움을 줍니다.
Low Avidity는 최근 1차 감염 가능성을 높게 시사하며, 태아 감염 위험 평가를 위한 추가 검사가 필요할 수 있습니다.
High Avidity는 과거 감염을 시사하며, 1차 감염에 비해 태아에게 심각한 문제가 발생할 위험은 훨씬 낮습니다. (단, CMV는 재감염/재활성화로 인한 태아 감염도 가능하므로 해석에 주의가 필요합니다.)
풍진(Rubella)은 임신 초기에 감염되면 선천성 풍진 증후군(심장 기형, 백내장, 난청 등)을 유발할 수 있습니다. MMR 백신 접종으로 발생률이 크게 감소했지만, 여전히 산전 검사가 중요합니다. 풍진 IgG/IgM 동시 양성 시 풍진 IgG Avidity 검사는 최근 감염과 과거 감염(또는 백신 접종 후 반응)을 감별하는 데 도움을 줄 수 있습니다. Low Avidity는 최근 감염 가능성을, High Avidity는 과거 감염이나 성공적인 백신 면역 반응을 시사합니다.
이처럼 임신 중 TORCH 감염 진단에서 IgG Avidity 검사는 불필요한 불안감을 줄여주고, 꼭 필요한 경우에 적절한 추적 검사나 예방적 조치를 결정하는 데 매우 중요한 역할을 합니다. 하지만 절대로 Avidity 검사 결과 하나만으로 최종 진단을 내려서는 안 됩니다. 반드시 산모의 임상 증상, 이전 검사 결과, 초음파 소견, 필요한 경우 양수 검사(PCR 등) 결과를 종합하여 감염병 전문가 또는 산부인과 전문의가 신중하게 판단해야 합니다. 이것은 아무리 강조해도 지나치지 않습니다.
기타 감염 질환에서의 활용
TORCH 감염 외에도 IgG Avidity 검사는 다양한 다른 감염성 질환의 진단 및 감염 시기 추정에 활용되거나 연구되고 있습니다.
엡스타인-바 바이러스(Epstein-Barr Virus, EBV)는 전염성 단핵구증(일명 '키스병')의 원인 바이러스입니다. EBV 감염 진단은 보통 특이 항체(VCA IgM, VCA IgG, EBNA IgG) 패널 검사를 통해 이루어지지만, 때로는 결과 해석이 모호하거나 비정형적인 증상을 보이는 경우가 있습니다. 이때 VCA IgG Avidity 검사가 급성 1차 감염(Low Avidity)과 과거 감염(High Avidity)을 감별하는 데 도움을 줄 수 있습니다. 특히 VCA IgM 위양성이 의심될 때 매우 유용하게 사용될 수 있습니다.
파보바이러스 B19(Parvovirus B19)는 어린이에게는 감염성 홍반(slapped cheek appearance)을 일으키고, 성인에게는 관절통 등을 유발할 수 있는 바이러스입니다. 임신 중 감염 시 태아에게 심각한 빈혈이나 태아 수종(hydrops fetalis)을 일으킬 수 있어 임신부 감염 진단이 중요합니다. 파보바이러스 B19 IgG Avidity 검사는 IgG/IgM 동시 양성 시 감염 시기를 추정하여 태아 위험도를 평가하는 데 도움을 줄 수 있습니다.
수두-대상포진 바이러스(Varicella-Zoster Virus, VZV)는 수두(1차 감염)와 대상포진(잠복 감염의 재활성화)을 일으키는 바이러스입니다. VZV IgG Avidity 검사는 1차 감염과 재활성화를 감별하거나, 백신 접종 후 면역 반응을 평가하는 데 활용될 가능성이 연구되고 있습니다. 일반적으로 1차 감염 시에는 Low Avidity, 재활성화 시에는 High Avidity를 보일 것으로 예상됩니다.
기타 감염: 라임병(Lyme disease)을 일으키는 Borrelia burgdorferi, 신증후군 출혈열을 일으키는 한타바이러스(Hantavirus) 등 다른 여러 감염병에서도 IgG Avidity 검사의 유용성에 대한 연구가 진행되고 있습니다. 이처럼 IgG Avidity 검사는 다양한 감염병 분야에서 감염 시기를 추정하고 진단의 정확성을 높이는 데 기여할 수 있는 잠재력을 가지고 있습니다. 하지만 각 질병에서의 Avidity 성숙 속도나 임상적 유용성은 다를 수 있으므로, 해당 분야의 최신 연구 결과와 전문가의 의견을 참고하는 것이 중요합니다.
이제 IgG Avidity 검사의 유용성에 대해 충분히 살펴보았으니, 마지막으로 이 검사가 가진 한계점과 결과를 해석할 때 반드시 주의해야 할 사항들을 짚어보며 마무리하도록 하겠습니다.
IgG Avidity 검사의 한계점 및 주의사항
지금까지 IgG Avidity 검사가 감염 시기 추정, 특히 임신 중 감염 진단에 얼마나 유용한 도구인지 살펴보았습니다. 하지만 세상에 완벽한 검사가 없듯이, IgG Avidity 검사 역시 몇 가지 본질적인 한계점을 가지고 있으며, 결과를 해석할 때는 반드시 주의해야 할 사항들이 있습니다. 이러한 한계와 주의점을 명확히 인지하지 못하고 결과를 맹신한다면, 오히려 잘못된 판단을 내릴 수도 있습니다. 따라서 다음 사항들을 반드시 기억하시기 바랍니다.
표준화 부족 (Lack of Standardization)
가장 큰 문제점 중 하나는 바로 검사 방법의 표준화가 부족하다는 것입니다. 앞서 검사 원리에서 설명했듯이, Avidity Index 값은 사용하는 ELISA 키트 제조사, 플레이트에 코팅된 항원의 종류와 품질, 사용되는 변성제(Urea, DEA 등)의 종류와 농도, 변성제 처리 시간, 그리고 결과 판정을 위한 기준값(Cut-off value) 등 다양한 기술적인 요인에 따라 달라질 수 있습니다.
이 때문에 서로 다른 검사실에서, 또는 동일 검사실이라도 다른 시약이나 방법을 사용하여 얻은 Avidity 결과를 직접적으로 비교하기 어렵습니다. A 검사실에서 'High Avidity'로 판정된 결과가 B 검사실에서는 'Intermediate'로 나올 수도 있다는 의미입니다. 이는 결과 해석에 혼란을 야기하고 검사의 신뢰성을 떨어뜨릴 수 있는 심각한 문제입니다.
이러한 문제를 해결하기 위해 국제적인 표준화 노력과 함께, 각 검사실에서는 사용하는 검사법에 대한 엄격한 내부 검증(Validation)을 통해 자체적인 성능 특성(민감도, 특이도, 기준값 등)을 확립하고, 임상검사정도관리(Quality Assurance) 프로그램을 철저히 운영해야 합니다. 또한, 가능하다면 CLSI(Clinical and Laboratory Standards Institute)와 같은 공신력 있는 기관에서 제시하는 가이드라인을 따르는 것이 권장됩니다. 결과를 받아보는 임상의사 역시 해당 검사실에서 사용하는 방법과 기준값을 인지하고 있어야 합니다.
해석의 어려움: 중간값(Intermediate/Borderline) 결과
Avidity Index 값이 Low도 High도 아닌 어중간한 중간값(Intermediate 또는 Borderline) 범위에 속하는 경우, 그 해석이 매우 어렵다는 점도 한계입니다. 이러한 결과는 앞서 언급했듯이, 최근 감염에서 과거 감염으로 이행하는 과도기 상태를 반영하는 것일 수도 있고, 개인의 면역 반응 특성상 Avidity 성숙이 느리거나 불완전하여 나타나는 현상일 수도 있습니다. 또는 검사 자체의 변동성(Variability)에 의한 결과일 수도 있습니다.
중간값 Avidity 결과만으로는 감염 시기에 대해 명확한 결론을 내릴 수 없습니다. 따라서 이러한 결과가 나왔을 때는, 환자의 임상 경과를 면밀히 관찰하면서 2~4주 정도의 시간 간격을 두고 IgG Avidity 재검사를 시행하는 것이 일반적입니다.
재검사 시 Avidity Index가 의미 있게 증가하는지(즉, High Avidity로 변하는지)를 확인하여 감염 시기를 보다 정확하게 추정할 수 있습니다. 만약 변화가 없거나 여전히 중간값 범위에 머무른다면 과거 감염일 가능성도 고려해야 합니다. 또한, 가능하면 PCR과 같은 병원체 직접 검출 검사나 다른 혈청학적 표지자 검사 결과를 함께 참고하여 종합적으로 판단해야 합니다. 절대로 중간값 결과 하나만으로 성급한 결정을 내려서는 안 됩니다.
Avidity 성숙 속도의 개인차
IgG Avidity가 성숙하는 속도는 모든 사람에게 동일하지 않습니다. 이는 개인의 면역 체계 상태(예: 면역 저하 환자), 감염된 병원체의 종류와 항원 특성, 감염 경로, 감염 당시의 항원량, 그리고 유전적인 요인 등 다양한 변수에 의해 영향을 받습니다.
어떤 사람들은 감염 후 비교적 빠르게 High Avidity IgG를 생성하는 반면, 어떤 사람들은 수개월 이상 Low 또는 Intermediate Avidity 상태가 지속될 수도 있습니다. 심지어는 감염 후 상당한 시간이 흘렀음에도 불구하고 Avidity 성숙이 제대로 이루어지지 않아 계속 Low Avidity를 보이는 경우도 드물게 보고됩니다.
이러한 개인 간의 차이(Inter-individual variation) 때문에, Avidity Index 값만으로 감염 시기를 '칼같이' 정확하게 특정하는 데는 한계가 있습니다. Avidity 결과는 확률적인 정보를 제공하는 것이지, 확정적인 시간표를 제공하는 것이 아님을 이해해야 합니다. 따라서 결과 해석 시에는 항상 이러한 개인차의 가능성을 염두에 두어야 합니다.
재감염/재활성화 시 Avidity 변화
IgG Avidity 검사는 주로 급성 1차 감염(Primary infection)과 과거 감염을 구별하는 데 초점이 맞춰져 있습니다. 하지만 이미 과거에 감염되었던 사람이 동일한 병원체에 다시 노출되어 발생하는 재감염(Reinfection)이나, 몸 안에 잠복해 있던 바이러스가 다시 활동을 시작하는 재활성화(Reactivation)의 경우에는 Avidity 해석이 달라질 수 있습니다.
일반적으로 재감염이나 재활성화 시에는 우리 몸의 면역계가 이미 해당 항원을 기억하고 있기 때문에, 매우 신속하게 다량의 High Avidity IgG 항체를 만들어냅니다. 즉, 재감염/재활성화 초기에도 Avidity 검사 결과는 High Avidity로 나올 가능성이 높습니다.
따라서 High Avidity 결과가 반드시 '오래된 과거 감염'만을 의미하는 것은 아니며, 최근에 발생한 재감염/재활성화일 가능성도 배제할 수 없습니다. 물론, 재감염/재활성화 시에는 IgM 항체가 나타나지 않거나 매우 약하게 나타나는 경우가 많고, IgG 항체 역가(titer)가 급격하게 상승하는 양상을 보이는 등 다른 혈청학적 단서들이 동반될 수 있습니다.
따라서 Avidity 결과와 함께 IgM 항체 변화, IgG 항체 역가 변화 추이, 환자의 임상 증상 및 과거 병력 등을 종합적으로 고려해야 1차 감염과 재감염/재활성화를 감별할 수 있습니다. Avidity 검사 하나만으로는 이 둘을 명확히 구분하기 어려울 수 있다는 점을 인지해야 합니다.
특정 질환에서의 제한적 유용성
IgG Avidity 검사가 모든 감염성 질환에서 동일하게 유용한 것은 아닙니다. 어떤 질환에서는 IgG Avidity 성숙 패턴이 뚜렷하지 않거나, 감염 시기를 아는 것의 임상적 중요성이 상대적으로 낮을 수도 있습니다.
또한, 사용하는 항원의 특성이나 검사 방법의 한계로 인해 특정 질환에서는 Avidity 검사의 신뢰도나 유용성이 떨어질 수도 있습니다.
따라서 특정 감염병에 대해 IgG Avidity 검사를 적용하고자 할 때는, 해당 질환에서 Avidity 검사의 임상적 유용성, 성능 특성(민감도, 특이도), 그리고 해석 기준 등에 대한 충분한 과학적 근거와 연구 결과가 뒷받침되는지를 먼저 확인해야 합니다. 무분별하게 모든 감염병에 Avidity 검사를 적용하는 것은 바람직하지 않습니다.
검사 결과 해석 시 전문가의 중요성
마지막으로, 그리고 가장 중요하게 강조하고 싶은 점은, IgG Avidity 검사 결과는 절대로 단독으로 해석되어서는 안 된다는 것입니다. 이 검사는 어디까지나 복잡한 임상 퍼즐의 한 조각일 뿐입니다. 최종적인 진단과 환자 관리 결정은 반드시 환자를 직접 진료하는 임상의사(특히 감염병 전문가 또는 관련 분야 전문의)가 환자의 자세한 병력, 임상 증상 및 경과, 다른 혈청학적 검사 결과(IgM, IgG 역가 변화 등), 영상 검사 소견, 필요한 경우 병원체 직접 검출 검사(PCR, 배양 등) 결과 등 모든 이용 가능한 정보를 종합적으로 고려하여 내려야 합니다.
진단검사의학과 전문의 역시 검사 방법의 특성과 한계를 정확히 이해하고, 임상의사에게 결과의 의미와 해석 시 주의점을 명확하게 전달하는 역할을 해야 합니다.
환자나 보호자가 검사 결과지만 보고 스스로 감염 시기나 위험도를 판단하는 것은 매우 위험하며, 반드시 전문가와 상담해야 합니다.
결론적으로, IgG Avidity 검사는 매우 유용한 도구이지만, 그 한계를 명확히 알고 다른 정보들과 함께 신중하게 사용될 때 비로소 그 가치를 제대로 발휘할 수 있습니다.
결론 및 요약
이번 시간에는 우리 몸의 면역 반응 결과물인 IgG 항체의 '결합력(Avidity)'을 측정하여 감염 시기를 추정하는 데 도움을 주는 IgG Avidity 검사에 대해 아주 자세하고 깊이 있게 살펴보았습니다. 배경지식이 없는 분들도 이해하실 수 있도록 면역학의 기초부터 시작하여, 친화력(Affinity)과 결합력(Avidity)의 개념적 차이, Avidity가 감염 후 시간 경과에 따라 '성숙'하는 이유, 그리고 이를 이용한 검사 원리와 방법, 임상 적용 사례, 마지막으로 한계점과 주의사항까지 폭넓게 다루었습니다.
핵심 내용을 다시 한번 요약해 보겠습니다. IgG Avidity 검사는 항체가 항원에 얼마나 강하게 결합하는지를 측정하는 검사입니다. 우리 몸은 감염 초기에 만들어지는 IgG 항체는 항원과의 결합력이 약하지만 (Low Avidity), 시간이 지나면서 면역 시스템의 학습과 선택 과정을 통해 점점 더 강력하게 결합하는 IgG 항체를 만들어냅니다 (High Avidity). Avidity 검사는 이러한 결합력의 차이를 변성제(Denaturing agent)를 이용하여 측정함으로써, 현재 검출되는 IgG가 최근의 급성 1차 감염에 의한 것인지 (Low Avidity), 아니면 과거 감염의 증거인지 (High Avidity)를 간접적으로 추정할 수 있게 해줍니다.
이러한 원리 덕분에 IgG Avidity 검사는 특히 IgG와 IgM 항체가 동시에 양성으로 나와 감염 시기 판별이 애매한 경우에 매우 유용합니다. 대표적으로 임신 중 TORCH 감염(톡소플라스마, CMV, 풍진 등) 진단에서, 임신 중 발생한 위험한 1차 감염과 임신 전의 안전한 과거 감염을 구별하여 태아 위험도를 평가하고 적절한 산전 관리를 결정하는 데 결정적인 정보를 제공할 수 있습니다. 그 외에도 EBV, 파보바이러스 B19 등 다양한 감염 질환에서 감염 시기 추정 및 진단의 정확성을 높이는 데 활용될 수 있습니다.
하지만 IgG Avidity 검사는 검사 방법의 표준화 부족, 중간값 결과 해석의 어려움, Avidity 성숙 속도의 개인차, 재감염/재활성화 감별의 한계 등 몇 가지 중요한 한계점을 가지고 있습니다. 따라서 검사 결과를 해석할 때는 이러한 점들을 반드시 고려해야 하며, 절대로 Avidity 검사 결과 하나만으로 최종 진단을 내리거나 임상적 결정을 해서는 안 됩니다. 항상 환자의 임상 정보, 다른 검사 결과 등 모든 관련 정보를 종합하여 전문가가 신중하게 판단해야 합니다.
결론적으로, IgG Avidity 검사는 감염병 진단, 특히 감염 시기 추정이라는 까다로운 문제를 해결하는 데 강력하고 유용한 도구를 제공합니다. 그러나 이 도구를 올바르게 사용하기 위해서는 그 원리에 대한 깊은 이해와 함께, 결과 해석에 대한 신중함과 종합적인 접근 방식이 절대적으로 필요하다는 점을 다시 한번 강조하며 글을 마칩니다. 이 글이 IgG Avidity 검사에 대한 여러분의 이해를 높이는 데 도움이 되었기를 바랍니다.
2025.04.17 - [AI - IT] - OpenAI o-시리즈 모델의 새로운 도약 - o3와 o4-mini 완벽 분석
OpenAI o-시리즈 모델의 새로운 도약 - o3와 o4-mini 완벽 분석
정말 놀라운 시대에 살고 있다는 생각이 들지 않으신가요? 인공지능(AI)이 단순히 정보를 검색하고 정리하는 것을 넘어, 이제는 스스로 필요한 도구를 찾아 사용하고, 복잡한 문제를 해결하며,
labdoctor.tistory.com
2025.04.17 - [임상미생물] - 세균배양검사를 위한 배지의 종류
세균배양검사를 위한 배지의 종류
여러분, 혹시 병원에서 피검사나 소변검사를 받아보신 경험이 있으신가요? 때로는 의사 선생님께서 "세균 배양 검사를 해봅시다"라고 말씀하시는 경우도 있는데요, 도대체 눈에 보이지도 않는
labdoctor.tistory.com
2025.04.16 - [진단면역] - 면역 검사에서의 window period, affinity, avidity란
면역 검사에서의 window period, affinity, avidity란
혹시 이런 경험 없으신가요? 분명 몸에 이상 증상이 나타나서 병원을 찾아 감염병 검사를 받았는데, 결과는 '음성'으로 나왔습니다. 안심하고 일상으로 돌아갔지만, 며칠 뒤 혹은 몇 주 뒤 다시
labdoctor.tistory.com
2025.04.16 - [임상미생물] - 미생물 검사 자동화 배양법
미생물 검사 자동화 배양법
우리가 병원에 가서 피를 뽑거나 소변 검사를 할 때, 혹은 식품 회사에서 제품의 안전성을 확인할 때 빠지지 않는 과정이 있습니다. 바로 미생물 검사인데요. 눈에 보이지 않는 작은 생명체들이
labdoctor.tistory.com
참고문헌
- Montoya JG, Liesenfeld O. Toxoplasmosis. Lancet. 2004;363(9425):1965-1976.
- Remington JS, McLeod R, Wilson CB, Desmonts G. Toxoplasmosis. In: Remington JS, Klein JO, Wilson CB, Nizet V, Maldonado YA, eds. Infectious Diseases of the Fetus and Newborn Infant. 8th ed. Elsevier Saunders; 2016:chap 24.
- Lazzarotto T, Spezzacatena P, Pradelli P, et al. Avidity of immunoglobulin G directed against human cytomegalovirus during primary and secondary infections in immunocompetent and immunocompromised subjects. Clin Diagn Lab Immunol. 1999;6(4):499-503.
- Thomas HI, Morgan-Capner P. Rubella-specific IgG avidity: a comparison of methods. J Virol Methods. 1991;31(2-3):219-228.
- Gray JJ. Avidity of EBV VCA-specific IgG antibodies: use of an avidity index for the diagnosis of primary EBV infection. J Med Virol. 1995;45(2):177-181.
- Tolfvenstam T, Broliden K. Parvovirus B19 IgG avidity testing in clinical practice. J Clin Virol. 2009;45(3):233-236.
- Sauerbrei A, Wutzler P. Laboratory diagnosis of varicella-zoster virus infections. Herpes. 2006;13(2):35-41.
- Clinical and Laboratory Standards Institute (CLSI). Interpretive Criteria for Identification of Bacteria and Fungi by Targeted DNA Sequencing; Approved Guideline. CLSI document MM18-A. Wayne, PA: Clinical and Laboratory Standards Institute; 2008. (주의: Avidity 관련 직접적 CLSI 가이드라인은 제한적일 수 있으며, 최신 정보 확인 필요)
- Bodeus M, Feyder S, Goubau P. Avidity of IgG antibodies distinguishes primary from non-primary cytomegalovirus infection in pregnant women. Clin Diagn Virol. 1998;9(1):9-16.
- Lappalainen M, Hedman K. Serodiagnosis of toxoplasmosis. The impact of measurement of IgG avidity. Ann Ist Super Sanita. 2004;40(1):81-88.
- Eggers M, Bättiger B, Lazar H, Enders G. Characterization of IgG avidity for cytomegalovirus in pregnancy: comparison of 2 different assays. J Med Virol. 2000;62(3):325-331.
- Prince HE, Lapé-Nixon M. Role of cytomegalovirus (CMV) IgG avidity testing in diagnosing primary CMV infection during pregnancy. Clin Vaccine Immunol. 2014;21(10):1377-1384.
- Gutiérrez J, Maroto C, Piédrola G. IgG avidity test for the diagnosis of toxoplasmosis during pregnancy. Enferm Infecc Microbiol Clin. 1999;17(10):522-526.
- Sellier Y, Guilleminot T, Ville Y, Leruez-Ville M. Comparison of the VIDAS® cytomegalovirus (CMV) IgG avidity II and the Architect® CMV IgG avidity assays for the diagnosis of primary CMV infection in pregnant women. J Clin Virol. 2015;72:46-48.
- Lebech M, Andersen O, Christensen D, et al. Feasibility of neonatal screening for congenital toxoplasmosis in the absence of prenatal treatment. Lancet Infect Dis. 2009;9(11):697-703.
- Kanengisser-Pines B, Hazan Y, Pines G, et al. High cytomegalovirus IgG avidity is a reliable indicator of past infection in patients with positive IgM results. J Perinat Med. 2009;37(2):153-156.
- Grangeot-Keros L, Mayaux MJ, Lebon P, et al. Value of cytomegalovirus (CMV) IgG avidity index for the diagnosis of primary CMV infection in pregnant women. J Infect Dis. 1997;175(4):944-946.
- Lagrou K, Bodeus M, Van Ranst M, Goubau P. Evaluation of the new Architect cytomegalovirus immunoglobulin M (IgM), IgG, and IgG avidity assays. J Clin Microbiol. 2009;47(6):1695-1699.
- McDonald SL, Masters L, Ramien M, et al. Evaluation of commercial cytomegalovirus immunoglobulin G avidity assays. J Clin Microbiol. 2007;45(11):3776-3778.
- Hedman K, Lappalainen M, Söderlund M, Hedman L. Avidity of IgG in serodiagnosis of infectious diseases. Rev Med Microbiol. 1993;4(3):123-129.
'진단면역' 카테고리의 다른 글
| 면역 검사에서의 항체 간섭 현상의 원인과 기전, 해결방법 (2) | 2025.04.18 |
|---|---|
| 진단면역검사에서의 prozone, postzone 효과 (0) | 2025.04.18 |
| IgG avidity 검사의 원리와 적용법 (0) | 2025.04.18 |
| 면역 검사에서의 window period, affinity, avidity란 (1) | 2025.04.16 |
| 이종친화항체(Heterophile Ab)의 정의, 원인, 검사실에서의 간섭 현상과 해결책 (0) | 2025.04.08 |




댓글