혹시 주변에서, 혹은 뉴스에서 비교적 젊은 나이에 특별한 기저 질환 없이 뇌졸중이나 심근경색과 같은 심각한 혈전증을 경험했거나, 혹은 안타깝게도 원인을 알 수 없는 유산이 반복되는 경우를 접해보신 적 있으신가요? 이러한 예기치 못한, 때로는 생명을 위협하거나 깊은 슬픔을 안기는 사건들의 이면에는 루푸스 항응고인자(Lupus Anticoagulant, 이하 LA)라는, 이름부터 극심한 혼란을 야기하는 숨겨진 요인이 도사리고 있을 가능성이 있습니다. 이 이름, '항응고인자'라는 단어 때문에 당연히 혈액 응고를 방해하여 출혈 경향을 높일 것이라고 생각하기 쉽습니다. 하지만 실제 임상에서는 정반대로, 우리 몸의 혈관 내에서 비정상적인 혈전 생성을 강력하게 촉진하는 주요 인자 중 하나로 지목되고 있습니다.
"뭐라고? 이름이 '항응고인자'인데 혈전을 만든다고? 이건 앞뒤가 전혀 안 맞잖아! 무슨 뚱딴지같은 소리야?"
네, 충분히 그렇게 생각하실 수 있습니다. 이처럼 이름과 실제 역할이 180도 다른 경우는 의학 용어 중에서도 상당히 드물기 때문에 처음 접하는 분들은 극심한 혼란을 느낄 수밖에 없습니다. 도대체 왜 이런 역설적인 이름이 붙게 된 것일까요? 이 LA의 진짜 정체는 무엇이며, 우리 몸 안에서 정확히 어떤 기전을 통해 혈관을 막는 혈전을 만들어내는 걸까요? 그리고 이처럼 모순적인 특징을 가진 물질을 우리는 어떻게 검사하고 진단하여 그 위험성을 평가할 수 있을까요?

이번 시간에는 이 모든 의문점을 속 시원하게 해결해 드리고자 합니다. LA의 정확한 정의와 그 이름에 얽힌 역사적 배경 및 과학적 원리부터 시작하여, LA가 왜 임상적으로 중요한 의미를 가지며, 특히 항인지질항체증후군(Antiphospholipid Syndrome, APS)이라는 질환과 어떤 밀접한 관계를 맺고 있는지를 심층적으로 파헤쳐 볼 것입니다.
더 나아가, LA를 검출하기 위한 복잡하지만 논리적인 검사 과정의 각 단계별 원리와 주의점까지 상세하게 설명함으로써, 이 기묘한 이름 뒤에 감춰진 혈전증의 위험 신호를 명확하게 이해하고 경계할 수 있도록 안내해 드리겠습니다. 자, 이제 루푸스 항응고인자라는 역설의 세계로 깊이 들어가 볼 준비, 되셨습니까?
루푸스 항응고인자 그 이름에 숨겨진 오해

가장 먼저, 그리고 가장 강력하게 강조해야 할 사실은, 루푸스 항응고인자(LA)는 우리 몸의 정상적인 혈액 응고 시스템을 조절하는 생리적인 '항응고인자(anticoagulant)'와는 전혀 다른 존재라는 점입니다. 이름에 완전히 속아서는 안 됩니다. LA의 진짜 정체는 면역 시스템의 오류로 인해 자신의 몸을 구성하는 특정 성분을 외부 침입자로 오인하여 공격하는 '자가항체(autoantibody)'의 한 종류입니다.
보다 구체적으로 설명하자면, LA는 혈액이 응고되는 복잡한 연쇄 반응 과정에 필수적인 발판 역할을 하는 인지질(phospholipid) 성분이나, 또는 이 인지질 분자와 결합하여 특정 기능을 수행하는 혈장 단백질(예: beta-2 glycoprotein I, prothrombin 등)을 표적으로 삼아 비정상적으로 생성된 항체들의 집합체를 의미하는 용어입니다 [1, 2].
그렇다면 어째서 이렇게 오해를 불러일으키기 쉬운 '항응고인자'라는 이름이 역사적으로 굳어지게 되었을까요? 이 역설적인 명칭의 탄생 배경에는 순전히 실험실 검사 환경(in vitro), 즉 시험관 내에서 관찰되는 독특한 현상이 자리 잡고 있습니다. LA는 혈액 응고 시간을 측정하는 특정 종류의 검사실 검사, 특히 검사 시약 내 인지질 농도를 의도적으로 낮춰서 검사의 민감도를 높인 조건에서 시행될 때, 혈액 응고 반응이 일어나는 데 필요한 인지질 표면을 방해하여 마치 혈액 응고를 억제하는 효과가 있는 것처럼 결과적으로 응고 시간을 비정상적으로 연장시키는 현상을 보입니다 [8].
이러한 현상이 1950년대 처음 기술되었고, 당시 주로 전신홍반루푸스(Systemic Lupus Erythematosus, SLE) 환자들에게서 이러한 특징을 보이는 혈액 응고 억제 물질이 발견되었기 때문에, '루푸스(Lupus)'와 '항응고인자(Anticoagulant)'라는 단어가 결합되어 명명된 것입니다 [3].
하지만 이것은 전적으로 시험관이라는 인공적인 환경 속에서의 관찰 결과일 뿐이라는 점을 명심해야 합니다. 실제 살아있는 우리 몸속(in vivo)의 혈관 내에서는 LA가 전혀 다른 얼굴을 보여줍니다. 즉, LA는 혈관 내피세포, 혈소판, 응고 인자 등 혈액 응고 시스템의 다양한 요소들과 복잡하게 상호작용하여 결과적으로 혈액이 비정상적으로 쉽게 응고되는 경향, 즉 동맥이나 정맥 내에 위험한 혈전(blood clot)을 형성하는 경향성, 즉 혈전증(thrombosis)을 강력하게 유발하는 주범으로 작용하는 것으로 밝혀졌습니다.
이것이야말로 LA가 단순한 검사실 이상 소견을 넘어 임상적으로 매우 중요하게 다루어져야 하는 핵심적인 이유입니다. 마치 실험실에서는 응고를 막는 천사처럼 보이지만, 실제 몸속에서는 혈관을 공격하여 혈전을 만드는 악마와 같은 이중성을 지닌다고 할 수 있습니다.
그렇다면 이 비정상적인 자가항체, LA는 구체적으로 무엇을 공격 목표로 삼는 것일까요? LA의 주요 표적은 세포막의 구성 성분이면서 특히 음전하(-)를 띠고 있는 인지질 분자들, 대표적으로 포스파티딜세린(phosphatidylserine)과 포스파티딜에탄올아민(phosphatidylethanolamine) 등이 있습니다 [1]. 정상적인 혈액 응고 과정은 손상된 혈관 부위나 활성화된 세포 표면에 노출된 이러한 음전하 인지질을 발판 삼아 여러 혈액 응고 인자들이 순차적으로 모여들어 복합체(예: 테네이즈 복합체, 프로트롬비나제 복합체)를 형성하면서 폭발적으로 진행됩니다.
LA는 바로 이 과정에 필수적인 인지질 자체에 결합하거나, 혹은 이 인지질들과 강하게 결합하는 특정 혈장 단백질들, 특히 베타-2 글리코프로테인 I (β2-glycoprotein I, β2GPI) 또는 혈액 응고의 핵심 효소인 프로트롬빈(prothrombin, Factor II)과 같은 단백질들에 결합하여, 시험관 내에서는 응고 복합체 형성을 방해하고(응고 시간 연장), 생체 내에서는 오히려 혈전 생성을 촉진하는 복잡한 기전을 통해 작용하는 것으로 생각됩니다 [1, 2, 6].
이러한 비정상적인 자가항체는 도대체 왜 만들어지는 것일까요? 안타깝게도 LA를 포함한 항인지질항체의 정확한 생성 기전은 아직까지 완전히 규명되지 않았습니다. 하지만 몇 가지 관련 요인들이 알려져 있습니다. 가장 흔하게는 전신홍반루푸스(SLE)와 같은 다른 자가면역질환을 앓고 있는 환자들에서 동반되어 발견되는 경우가 많습니다 [3].
이 외에도 특정 종류의 감염(예: HIV, C형 간염 바이러스, 매독, 말라리아 등)이나 특정 약물(예: 항정신병 약물인 페노티아진 계열, 부정맥 치료제인 프로카인아미드, 고혈압 약물인 하이드랄라진 등)에 대한 반응으로 일시적 또는 지속적으로 LA가 생성될 수도 있습니다 [1, 3]. 때로는 특별한 기저 질환이나 유발 요인 없이 건강한 사람에게서 일시적으로 나타났다가 저절로 사라지기도 하며, 원인을 알 수 없이 발생하는 경우(특발성)도 있습니다.
결론적으로, 루푸스 항응고인자의 정의를 명확히 이해하는 것이 무엇보다 중요합니다. LA는 이름과는 정반대로 항응고제가 아닌, 인지질 또는 인지질-결합 단백질을 표적으로 하는 자가항체 그룹이며, 시험관 내에서는 인지질 의존적인 응고 검사 시간을 연장시키지만, 실제 살아있는 몸속에서는 혈전증 발생 위험을 현저히 증가시키는 역설적인 특징을 지닌다는 사실을 반드시 기억해야 합니다. 이 근본적인 정의와 이중성에 대한 이해가 LA의 임상적 중요성을 파악하고 복잡한 검사 과정을 해석하는 데 있어 가장 중요한 기초가 될 것입니다.
임상적 중요성 왜 루푸스 항응고인자를 주목해야 하는가
루푸스 항응고인자(LA)의 존재가 임상 현장에서 갖는 가장 심오하고 직접적인 중요성은, 바로 항인지질항체증후군(Antiphospholipid Syndrome, 이하 APS)이라는 특정 자가면역 질환의 진단 및 위험도 평가에 있어 핵심적인 역할을 수행한다는 점입니다. 실제로, LA 양성은 APS를 진단하기 위해 국제적으로 합의된 분류 기준(classification criteria)에 포함된 세 가지 주요 실험실 검사 소견 중 하나로 확고하게 인정받고 있습니다 [4, 5].
나머지 두 가지 중요한 항체는 각각 항카디오리핀 항체(anticardiolipin antibody, aCL)와 항베타-2 글리코프로테인 I 항체(anti-β2 glycoprotein I antibody, aβ2GPI)입니다. 이 세 가지 항체 중 하나 이상이 일정 기준치 이상으로 지속적으로 검출되는 것이 APS 진단의 필수적인 실험실 요건입니다.

그렇다면 이 항인지질항체증후군(APS)이란 정확히 어떤 병일까요? 조금 더 자세히 정의하자면, APS는 혈액 내에 앞서 언급한 항인지질항체들(LA, aCL IgG/IgM, aβ2GPI IgG/IgM 중 하나 이상)이 기준치 이상으로, 그리고 일시적이 아닌 지속적(최소 12주 간격 반복 검사에서 양성)으로 존재하는 것이 확인되면서, 동시에 환자에게 특징적인 임상 사건, 즉 동맥 또는 정맥 내 혈전증(thrombosis)이 발생하거나, 혹은 임신과 관련된 특정 합병증(특히 설명되지 않는 반복적인 임신 초기(10주 유산 3회 이상, 임신 10주 이후의 원인 불명 태아 사망 1회 이상, 또는 전자간증(preeclampsia), 자간증(eclampsia)이나 심각한 태반 기능 부전(placental insufficiency)으로 인해 임신 34주 이전에 조산한 병력 1회 이상) 중 하나 이상이 동반되는 경우로 정의되는 후천성, 전신성 자가면역 혈전성향증(acquired autoimmune thrombophilia)입니다 [4].
쉽게 말해, 면역체계의 이상으로 인해 혈관 내에 혈전이 비정상적으로 잘 생기게 되는 체질이 되는 병이라고 이해할 수 있습니다. APS는 다른 자가면역질환 없이 단독으로 발생할 수도 있으며(이를 원발성 APS, Primary APS라고 합니다), 혹은 전신홍반루푸스(SLE)와 같은 다른 류마티스성 질환이나 자가면역질환과 함께 동반되어 나타날 수도 있습니다(이를 이차성 APS, Secondary APS라고 합니다).
여기서 다시 한번 근본적인 의문이 제기됩니다. 도대체 왜 LA를 포함한 항인지질항체들이 시험관이라는 인공적인 환경에서는 혈액 응고를 방해하는 것처럼 보이면서, 실제 살아있는 몸속에서는 혈전을 만드는 정반대의 결과를 초래하는 것일까요? 이 역설적인 현상, 즉 'LA 패러독스(LA paradox)'의 정확한 분자 기전은 매우 복잡하며 아직도 100% 완벽하게 규명되지는 않았습니다. 하지만 지난 수십 년간의 연구를 통해 여러 중요한 기전들이 밝혀졌으며, 이 항체들이 단순히 하나의 경로만을 통해 작용하는 것이 아니라, 혈액 응고 및 항응고 시스템의 여러 단계에 다각적으로 영향을 미쳐 궁극적으로 혈관 내 환경을 혈전 생성 쪽으로 기울게 만드는(prothrombotic or hypercoagulable state) 것으로 이해되고 있습니다 [1, 6].
현재까지 밝혀진 주요 병태생리 기전들을 종합해보면 다음과 같습니다: LA를 포함한 항인지질항체들은 혈관 가장 안쪽을 덮고 있는 혈관 내피세포(endothelial cells)를 공격하고 활성화시켜, 염증 반응을 유발하고 혈전 생성을 개시하는 중요한 분자인 조직 인자(tissue factor)의 발현을 증가시킵니다. 또한, 혈액 응고의 초기 단계에 중요한 역할을 하는 혈소판(platelets)의 활성화 및 응집을 비정상적으로 촉진합니다. 혈액 내 염증 세포인 단핵구(monocytes) 역시 이 항체들에 의해 활성화되어 조직 인자 발현을 늘리고 염증성 사이토카인을 분비하여 혈전 생성을 더욱 부추깁니다.
더욱이, 우리 몸에는 혈액이 과도하게 응고되는 것을 막는 자연적인 항응고 시스템이 존재하는데(예: 단백질 C-단백질 S 시스템), 이 항체들은 이 시스템의 기능을 억제하여 항응고 방어벽을 약화시킵니다. 또한, 한번 생성된 혈전을 분해하여 제거하는 과정인 섬유소 용해(fibrinolysis) 시스템도 방해하는 것으로 알려져 있습니다. 특히, 베타-2 글리코프로테인 I (β2GPI)에 대한 항체는 이 단백질이 가진 본래의 항응고 기능을 억제하고, 오히려 β2GPI를 통해 세포 표면에 결합하여 세포 활성화를 유도하는 등 매우 복잡하고 다면적인 역할을 수행합니다. 세포 표면의 인지질을 보호하는 역할을 하는 아넥신 V(Annexin V)라는 단백질의 기능을 방해하여 인지질 노출을 증가시키는 기전도 제시되었습니다 [6]. 이처럼 LA는 혈액 응고 및 항응고 시스템의 섬세한 균형을 여러 지점에서 동시에 무너뜨림으로써, 결과적으로 혈관 내에 병적인 혈전이 쉽게 형성될 수 있는 환경을 조성하는 것입니다.
그렇다면 임상 현장에서 어떤 환자를 만났을 때, 혹은 어떤 상황에 처했을 때 루푸스 항응고인자 검사를 시행하는 것을 적극적으로 고려해야 할까요? 이는 매우 중요한 질문이며, 불필요한 검사를 남발하지 않으면서도 꼭 필요한 환자를 놓치지 않기 위해 국제적인 가이드라인에서는 다음과 같은 경우에 APS 및 LA 검사를 시행할 것을 구체적으로 권고하고 있습니다 [4, 5, 9].
- 명확한 유발 요인 없이 발생한 동맥 또는 정맥 혈전증: 특히 혈전증의 일반적인 위험인자(고령, 장기간 부동, 수술, 암 등)가 없는 50세 미만의 젊은 환자에게서 발생했거나, 뇌정맥동, 간정맥(버드-키아리 증후군), 신정맥, 망막 혈관 등과 같이 흔하지 않은 부위에 혈전증이 발생한 경우, 또는 적절한 항응고 치료에도 불구하고 혈전증이 재발하는 경우.
- 임신 관련 합병증: 특히 명확한 원인을 찾을 수 없는 임신 손실이 반복되는 경우, 구체적으로는 임신 10주 이후의 형태학적으로 정상이었던 태아가 원인 불명으로 사망한 경우가 1회 이상 있었거나, 또는 임신 10주 이전에 연속적으로 3회 이상 자연 유산된 경우. 또한 임신 중 심각한 고혈압 질환인 전자간증이나 자간증이 발생했거나, 또는 심각한 태반 기능 부전으로 인해 태아 성장 제한 등이 동반되어 임신 34주 이전에 불가피하게 조산한 병력이 1회 이상 있는 경우.
- 다른 전신 자가면역 질환, 특히 전신홍반루푸스(SLE)를 진단받은 환자: SLE 환자의 상당수에서 항인지질항체가 동반될 수 있으며, 이는 혈전증 및 임신 합병증 위험을 높이므로 선별 검사가 필요할 수 있습니다.
- 원인을 알 수 없는 혈소판 감소증(thrombocytopenia)이 지속되는 경우: APS 환자에서 혈소판 감소증이 동반되는 경우가 드물지 않습니다.
- 다른 이유로 시행한 일반 혈액 응고 검사(특히 aPTT)에서 우연히 설명되지 않는 현저한 응고 시간 연장이 발견된 경우: 비록 출혈 경향은 없더라도, 이것이 LA 존재의 첫 단서일 수 있으므로 추가적인 정밀 검사를 고려해야 합니다.
이러한 임상적 의심 소견이 있을 때 LA를 포함한 항인지질항체 검사를 체계적으로 시행하여 APS를 정확히 진단하는 것은 매우 중요합니다. 왜냐하면 APS로 진단될 경우, 단순히 혈전을 치료하는 것을 넘어, 혈전의 재발을 예방하기 위한 장기간의 강력한 항응고 요법(예: 와파린 복용, INR 목표치를 높게 유지)이 필요할 수 있으며, 임신을 계획하는 여성의 경우 임신 관련 합병증을 예방하고 성공적인 출산을 돕기 위한 특별한 관리 및 치료(예: 저용량 아스피린과 예방적 용량의 헤파린 병용 요법)가 필수적이기 때문입니다. 특히 여러 연구에서 LA 양성은 다른 항인지질항체(aCL, aβ2GPI) 양성보다 혈전증 발생 위험이 더 높고, 재발률도 더 높다는 결과를 보고하고 있어 [10], LA의 존재 유무를 확인하는 것은 환자의 위험도를 평가하고 치료 강도를 결정하는 데 있어 매우 중요한 정보를 제공합니다.
루푸스 항응고인자 검사법 복잡하지만 정밀한 다단계 진단 과정
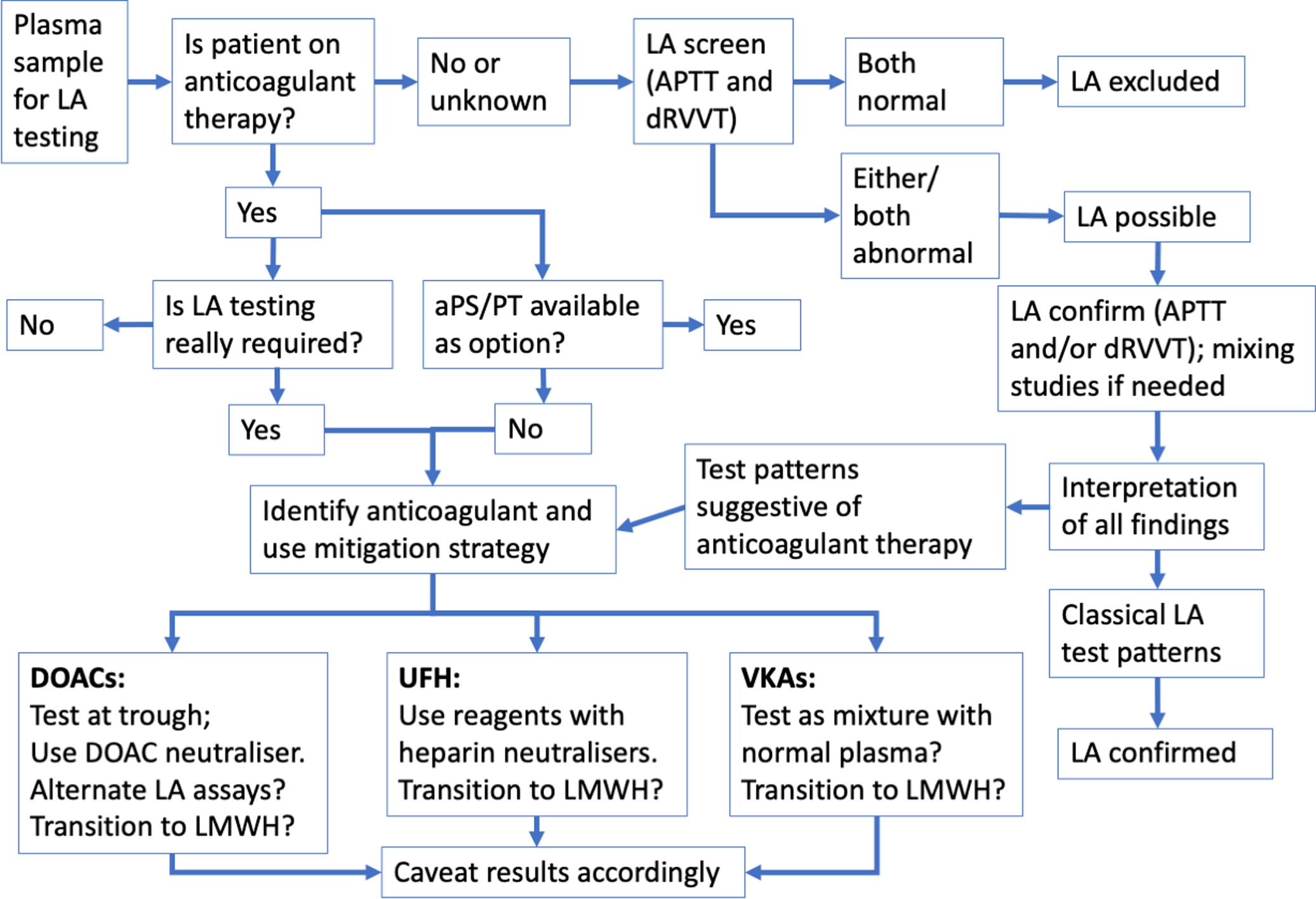
루푸스 항응고인자(LA)를 검사실에서 정확하게 검출하고 진단하는 과정은, 안타깝게도 혈당이나 콜레스테롤처럼 단 하나의 간단한 검사 수치로 명확하게 결론 내릴 수 있는 성질의 것이 아닙니다. 그 이유는 LA 자체가 단일한 항체가 아니라, 서로 다른 다양한 종류의 인지질 분자 또는 인지질과 결합하는 단백질들을 표적으로 삼는 매우 이질적인(heterogeneous) 자가항체들의 집합체이기 때문입니다 [8]. 이는 환자마다 가지고 있는 LA의 구체적인 표적과 항체 특성(예: 항체 종류 IgG, IgM, IgA, 친화도 등)이 다를 수 있음을 의미하며, 따라서 검사실에서 사용하는 검사 시약의 종류, 특히 시약에 포함된 인지질의 종류와 농도 구성에 따라 LA를 검출하는 민감도와 특이도가 크게 달라질 수 있습니다.
게다가 상황을 더욱 복잡하게 만드는 요인은, 혈전증 예방이나 치료를 위해 이미 헤파린(Heparin)이나 와파린(Warfarin)과 같은 전통적인 항응고제를 투여받고 있거나, 혹은 최근 사용이 늘고 있는 직접 경구 항응고제(Direct Oral Anticoagulants, DOACs)를 복용 중인 환자의 경우, 이 약물들이 LA 검사 자체의 원리에 직접적인 영향을 미쳐 응고 시간을 연장시킴으로써, 실제로는 LA가 없는데도 있는 것처럼 보이는 위양성(false positive) 결과를 초래하거나, 혹은 약물의 항응고 효과가 LA의 약한 억제 효과를 가려버려 실제로는 LA가 있는데도 없는 것처럼 보이는 위음성(false negative) 결과를 유발할 수 있다는 점입니다.
이러한 내재적인 복잡성과 잠재적인 간섭 요인들 때문에, 루푸스 항응고인자 검사는 반드시 국제혈전지혈학회(International Society on Thrombosis and Haemostasis, ISTH)에서 제정하고 지속적으로 업데이트하는 국제적인 가이드라인에 따라, 여러 단계를 거치는 체계적이고 논리적인 접근법을 사용하여 수행되어야 합니다. 이 표준화된 접근법의 핵심 목표는 환자의 혈장(plasma) 내에 LA가 존재한다는 것을 다음 세 가지 특징적인 기준을 순차적으로, 그리고 명확하게 증명하는 것입니다 [8, 9].
- 기준 1: 인지질 의존성 응고 시간의 연장 증명: 먼저, 환자 혈장이 인지질이 필수적으로 요구되는 하나 이상의 혈액 응고 검사에서 정상 대조군에 비해 통계적으로 유의미하게 연장된 응고 시간을 보이는지를 확인합니다. 이는 LA가 존재할 가능성이 있음을 시사하는 첫 번째 단계입니다.
- 기준 2: 억제 물질(Inhibitor)의 존재 증명 (혼합 검사를 통해): 다음으로, 관찰된 응고 시간 연장이 단순히 특정 혈액 응고 인자의 부족(결핍, deficiency) 때문이 아니라, 혈액 응고 과정을 방해하는 억제 물질(inhibitor), 즉 LA와 같은 항체가 존재하기 때문이라는 것을 증명합니다. 이는 환자 혈장과 정상 혈장을 섞어 검사하는 혼합 검사를 통해 이루어집니다.
- 기준 3: 억제 물질의 인지질 의존성 확증: 마지막으로, 확인된 억제 물질이 다른 종류의 억제제(예: 특정 응고 인자에 대한 특이 억제제)가 아니라, 명확하게 '인지질에 의존하여' 작용하는 특성을 가지고 있음을, 즉 LA임을 최종적으로 확증합니다. 이는 검사 시스템에 인지질 농도를 변화시켜 응고 시간 변화를 관찰함으로써 증명됩니다.
이 세 가지 핵심 기준을 체계적으로 검증하기 위해, 실제 검사실에서는 다음과 같은 단계적인 검사가 순차적으로, 또는 때로는 통합적으로 진행됩니다. 아래 표는 이 과정을 요약한 것입니다.
루푸스 항응고인자(LA) 검사 단계 요약
| 단계 | 검사 목적 | 주요 검사법 예시 | 핵심 원리/판정 기준 |
|---|---|---|---|
| 1. 선별 검사 | 인지질 의존성 응고 시간 연장 확인 (LA 가능성 탐색) | dRVVT (Screen), LA-sensitive aPTT | 저농도 인지질 시약 사용. 응고 시간이 정상 범위 초과 시 다음 단계 진행. 최소 2가지 검사 병행 권장. |
| 2. 혼합 검사 | 응고 시간 연장의 원인 감별 (결핍 vs 억제 물질) | 환자 혈장 + 정상 혈장 혼합 후 재검사 | 응고 시간 연장이 교정되지 않으면(uncorrected) 억제 물질(LA) 존재 시사. |
| 3. 확증 검사 | 억제 물질의 인지질 의존성 최종 확인 (LA 확증) | dRVVT (Confirm), Hexagonal phase aPTT | 고농도 인지질 시약 추가 시 응고 시간 연장이 유의하게 단축(교정)되는지 확인 (Ratio 또는 % Correction 계산). |
1단계 선별 검사 (Screening Tests) LA 존재 가능성 탐색
LA 검사 여정의 첫 번째 관문은 환자의 혈장 내에 인지질 의존적인 혈액 응고 시간을 연장시키는 물질, 즉 LA가 존재할 가능성이 있는지를 스크리닝(screening)하는 단계입니다. 이 단계의 핵심 원리는 검사 시약 내 인지질(phospholipid)의 농도를 의도적으로 낮게 조절하여 사용하는 것입니다. 왜냐하면 인지질 농도가 낮을수록, 만약 LA가 존재한다면 그 LA가 상대적으로 응고 반응에 미치는 억제 영향력이 커지게 되어, 결과적으로 응고 시간의 연장이 더욱 뚜렷하고 민감하게 관찰될 수 있기 때문입니다.
현재 LA 선별 검사로 가장 널리 사용되고 권장되는 검사법들은 다음과 같습니다 [8, 9].
- 희석 러셀 바이퍼 독 시간 (dilute Russell Viper Venom Time, dRVVT): 이 검사는 이름에서 알 수 있듯이 러셀 바이퍼(Russell's viper)라는 독사의 독액(venom)을 이용합니다. 이 독액에는 혈액 응고 연쇄 반응의 중간 단계에 있는 제 10 응고 인자(Factor X)를 직접적으로 활성화시키는 효소가 포함되어 있어, 비교적 간단하게 혈액 응고를 유발할 수 있습니다. dRVVT는 특히 LA 검출에 있어 높은 민감도와 특이도를 보이는 것으로 잘 알려져 있으며, 검사법 명칭에 포함된 '희석(dilute)'이라는 단어는 검사 시약 내 인지질 농도를 낮게 조절하여 LA에 대한 민감도를 높였다는 의미를 내포합니다. 만약 환자 혈장 내에 LA가 존재한다면, 이 LA는 활성화된 제 10 응고 인자(Factor Xa), 제 5 응고 인자(Factor V), 인지질, 그리고 칼슘 이온(Ca²⁺)으로 구성되어 프로트롬빈을 트롬빈으로 전환시키는 핵심적인 효소 복합체인 '프로트롬비나제 복합체(prothrombinase complex)'의 형성을 인지질 표면에서 방해함으로써 dRVVT 응고 시간을 연장시키게 됩니다.
- 활성화 부분 트롬보플라스틴 시간 (Activated Partial Thromboplastin Time, aPTT) 기반 검사: aPTT는 혈액 응고의 내인성 경로(intrinsic pathway)와 공통 경로(common pathway)의 전반적인 기능을 평가하기 위해 임상에서 매우 흔하게 사용되는 일반적인 응고 선별 검사입니다. 하지만 LA 검출 목적으로 aPTT를 사용할 때는 주의가 필요합니다. 왜냐하면 시중에 나와 있는 다양한 aPTT 시약들은 각기 다른 종류와 농도의 인지질 및 활성제(activator)를 포함하고 있기 때문에, LA에 대한 민감도가 시약마다 크게 다를 수 있기 때문입니다. 따라서 LA 검출을 위해서는 LA에 대해 민감도가 높다고 검증된 특정 aPTT 시약(LA-sensitive aPTT reagent)을 사용하는 것이 매우 중요합니다. LA는 내인성 경로의 여러 단계, 특히 제 8 응고 인자(Factor VIIIa)와 제 9 응고 인자(Factor IXa)가 인지질 표면에서 형성하는 '테네이즈 복합체(tenase complex)'나 앞서 언급한 프로트롬비나제 복합체의 형성을 방해하여 aPTT 응고 시간을 연장시킬 수 있습니다.
- 카올린 응고 시간 (Kaolin Clotting Time, KCT): 이 검사는 활성제로 카올린(kaolin)을 사용하고 인지질을 거의 첨가하지 않아 LA에 매우 민감하게 반응하는 검사법 중 하나로 알려져 있습니다. 하지만 검사 방법의 표준화가 어렵고 다른 요인에 의해 영향을 받기 쉬워 현재는 예전만큼 널리 사용되지는 않는 추세입니다.
- 희석 프로트롬빈 시간 (dilute Prothrombin Time, dPT) 또는 프로트롬빈 시간-LA (PT-LA) 검사: 일반적인 프로트롬빈 시간(PT) 검사는 주로 외인성 경로(extrinsic pathway)를 평가하며 LA에 덜 민감한 것으로 알려져 있습니다. 하지만 일부 LA는 프로트롬빈(Factor II) 자체에 대한 자가항체이거나, 또는 프로트롬비나제 복합체 기능에 영향을 미쳐 PT 시간을 연장시킬 수도 있습니다. 특히 인지질 농도를 낮춘 dPT 시약을 사용하면 이러한 경우 LA를 검출하는 데 도움이 될 수 있습니다.
ISTH 가이드라인에서는 LA의 이질적인 특성을 고려하여 검출률을 극대화하기 위해, 서로 다른 응고 경로 단계나 원리에 기반하여 작용하는 최소 2가지 이상의 선별 검사법을 병행하여 사용할 것을 강력히 권고하고 있습니다 [9]. 예를 들어, 프로트롬비나제 복합체를 주로 평가하는 dRVVT 기반 검사와 내인성 경로의 테네이즈 및 프로트롬비나제 복합체를 함께 평가하는 LA-sensitive aPTT 기반 검사를 동시에 시행하는 것이 일반적인 조합입니다. 이 중 하나 이상의 선별 검사 결과가 해당 검사실에서 설정한 정상 범위를 유의하게 초과하여 연장된 소견을 보일 경우, LA의 존재 가능성을 염두에 두고 다음 단계 검사를 진행하게 됩니다.
2단계 혼합 검사 (Mixing Test) 억제 물질 존재 여부 감별
1단계 선별 검사에서 응고 시간 연장이 확인되었다면, 이제 그 연장의 원인이 무엇인지를 밝혀내야 합니다. 응고 시간이 길어지는 이유는 크게 두 가지 가능성이 있습니다. 첫째는 혈액 응고에 필요한 특정 응고 인자(들)(coagulation factor(s))가 선천적으로 또는 후천적으로 부족(결핍, deficiency)한 경우이고, 둘째는 혈액 응고 과정을 방해하는 억제 물질(inhibitor), 즉 LA와 같은 항체가 존재하는 경우입니다. 이 두 가지 가능성을 감별하는 것이 바로 혼합 검사(mixing test)의 목적입니다.
혼합 검사의 원리는 비교적 간단합니다. 환자의 혈장(plasma)과 모든 응고 인자를 정상적으로 함유하고 있는 정상인 혈장(normal pooled plasma, NPP)을 일반적으로 1:1 비율로 혼합합니다. 그런 다음, 1단계에서 연장되었던 선별 검사(예: dRVVT 또는 aPTT)를 이 혼합된 혈장을 사용하여 다시 시행합니다.
검사 결과는 다음과 같이 해석합니다.
- 만약 환자의 응고 시간 연장 원인이 단순히 특정 응고 인자(예: Factor VIII 또는 Factor IX)의 결핍 때문이었다면, 정상 혈장을 섞어줌으로써 부족했던 응고 인자가 약 50% 수준으로 보충됩니다. 대부분의 응고 인자는 30~40% 정도의 활성도만 있어도 응고 시간을 정상 범위로 유지할 수 있으므로, 이 경우 혼합 혈장의 응고 시간은 정상 범위 내로 교정(corrected)되는 결과를 보입니다.
- 하지만 만약 원인이 LA와 같은 억제 물질의 존재 때문이라면, 이 억제 물질은 환자 자신의 응고 인자뿐만 아니라 섞어준 정상 혈장에 포함된 응고 인자의 작용까지도 즉시 방해하게 됩니다. 따라서 정상 혈장을 섞어주어도 응고 시간 연장이 교정되지 않거나(uncorrected), 혹은 약간 단축되더라도 여전히 정상 범위보다는 유의하게 길게 유지되는, 즉 부분적인 교정(partially corrected)만을 보이게 됩니다.
따라서, 혼합 검사를 시행한 결과, 선별 검사에서 보였던 응고 시간 연장이 유의하게 교정되지 않는다면, 이는 응고 인자 결핍보다는 LA와 같은 억제 물질의 존재를 강력하게 시사하는 중요한 소견입니다. 혼합 검사는 일반적으로 환자 혈장과 정상 혈장을 혼합한 직후에 즉시 시행하는 것(immediate mixing test) 외에도, 혼합된 혈장을 37°C에서 1시간 또는 2시간 동안 배양(incubation)한 후에 다시 응고 시간을 측정하는 방법(incubated mixing test)도 함께 시행하는 경우가 많습니다. 이는 제 8 응고 인자(Factor VIII)에 대한 특이 억제제와 같이 시간과 온도에 의존하여 점진적으로 억제 효과가 강해지는 일부 억제제들을 감별하는 데 도움이 됩니다. 루푸스 항응고인자(LA)는 일반적으로 이러한 시간 및 온도 의존성이 크지 않은 즉시 작용형 억제제(immediate-acting inhibitor)의 특징을 보이는 경우가 많습니다.
3단계 확증 검사 (Confirmatory Tests) 인지질 의존성 최종 확인
2단계 혼합 검사를 통해 응고 시간 연장의 원인이 억제 물질 때문이라는 것이 밝혀졌다면, 이제 마지막으로 그 억제 물질이 정말로 '인지질에 의존적(phospholipid-dependent)'으로 작용하는 특성을 가지고 있는지, 즉 LA임을 최종적으로 확증하는 단계가 필요합니다. 왜냐하면 혈액 응고를 억제하는 물질에는 LA 외에도 특정 응고 인자(예: Factor VIII, Factor V)에 대한 특이적인 항체나, 드물게는 헤파린 유사 물질 등 다른 종류의 억제제들도 존재할 수 있기 때문입니다. 확증 검사는 이러한 다른 억제제들과 LA를 명확하게 구별하는 데 필수적입니다.
이 단계의 핵심 원리는 LA가 인지질에 의존하여 응고 과정을 방해한다는 특성을 역으로 이용하는 것입니다. 즉, 만약 존재하는 억제 물질이 인지질 표면에 결합하여 작용하는 LA라면, 검사 시스템에 과량의 인지질을 인위적으로 추가해주면 어떻게 될까요? 추가된 과량의 인지질이 LA 항체와 결합하여 억제 효과를 중화시키거나 희석시키는 효과를 나타낼 것입니다. 따라서 LA에 의해 연장되었던 응고 시간이 과량의 인지질 존재 하에서는 유의하게 단축(짧아지는)되는 현상이 관찰될 것입니다. 반면, 만약 억제 물질이 특정 응고 인자 자체를 직접 공격하는 특이 억제제와 같이 인지질에 의존하지 않는 종류라면, 과량의 인지질을 추가해도 응고 시간 연장에는 거의 변화가 없을 것입니다.
이러한 원리를 이용하여 확증 검사는 보통 1단계 선별 검사와 짝을 이루어 설계된 시약을 사용하여 진행됩니다.
- dRVVT 기반 확증 검사: 가장 널리 사용되는 방법입니다. 1단계에서 사용했던 낮은 인지질 농도의 dRVVT 선별(Screen) 시약과 함께, 이와는 대조적으로 인지질 농도를 매우 높게 만든 dRVVT 확증(Confirm) 시약을 사용하여 각각의 응고 시간을 동일한 환자 혈장으로 측정합니다. 만약 LA가 존재한다면, 확증 시약(고농도 인지질)에서 측정한 응고 시간이 선별 시약(저농도 인지질)에서 측정한 시간보다 의미 있게 짧아져야 합니다. 이 결과를 객관적으로 정량화하기 위해, 검사실에서는 [(선별 시간) / (확증 시간)]으로 계산되는 비율(Ratio) 값을 구하거나, 혹은 [(선별 시간 - 확증 시간) / 선별 시간] × 100 (%)으로 계산되는 교정 정도(% Correction)를 산출합니다. 이 계산된 값이 각 검사실에서 미리 설정해 둔 기준치(cut-off value)를 초과하면, LA 양성으로 최종 판정하게 됩니다.
- aPTT 기반 확증 검사: aPTT를 이용한 확증 방법도 유사한 원리를 따릅니다. LA에 민감한 aPTT 시약을 이용한 선별 검사와 함께, 육각형 상 인지질(hexagonal phase phospholipid)이나 혈소판 파괴 추출물(platelet lysate)과 같이 인지질 농도가 매우 높은 특수 시약을 이용한 검사를 병행하여 시행합니다. 만약 과량의 인지질을 함유한 특수 시약을 사용했을 때, LA 민감성 aPTT 시약에서 연장되었던 응고 시간이 유의하게 단축되는 결과를 보인다면, LA의 인지질 의존성이 확증되었다고 판단합니다.
- 혈소판 중화 과정 (Platelet Neutralization Procedure, PNP): 과거에 비교적 흔히 사용되었던 방법 중 하나로, 인지질 성분이 풍부한 동결-융해 과정을 거친 혈소판(platelet lysate)을 환자의 혈장에 첨가한 후 aPTT를 측정하여, 첨가 전에 비해 응고 시간이 유의하게 단축되는지를 확인하는 방식입니다. 하지만 표준화 및 민감도 측면에서 한계가 있어 현재는 dRVVT 기반 검사나 다른 확증 검사법으로 대체되는 추세입니다.
이 3단계 확증 과정을 통해 억제 물질의 '인지질 의존성'이 명확하게 증명되어야만, 비로소 최종적으로 루푸스 항응고인자(LA) 양성으로 진단할 수 있는 것입니다.
검사 결과 해석 시 반드시 고려해야 할 중요 주의사항들
복잡한 다단계 과정을 거쳐 얻어진 루푸스 항응고인자(LA) 검사 결과를 최종적으로 해석하고 임상적 의미를 부여할 때는, 반드시 다음과 같은 몇 가지 중요한 사항들을 신중하게 고려해야 합니다. 이러한 주의사항들을 간과할 경우, 잘못된 진단이나 부적절한 치료 결정으로 이어질 수 있습니다.
항응고제 사용 여부의 철저한 확인 및 영향 평가
이것은 LA 검사 결과 해석에 있어 가장 중요하고 흔하게 부딪히는 문제입니다. 현재 혈전증 치료나 예방 목적으로 널리 사용되는 헤파린(미분획 헤파린 또는 저분자량 헤파린), 와파린(비타민 K 길항제), 그리고 최근 사용이 급증하고 있는 직접 경구 항응고제(Direct Oral Anticoagulants, DOACs; 예: 리바록사반, 아픽사반, 다비가트란 등)는 LA 검사의 거의 모든 단계(선별, 혼합, 확증)에 직접적인 영향을 미쳐 응고 시간을 연장시킴으로써 위양성(false positive) LA 결과를 초래할 가능성이 매우 높습니다 [8, 9]. 반대로, 매우 약한 LA 활성을 가진 환자가 항응고제를 복용 중이라면 약물의 효과에 가려져 위음성(false negative) 결과가 나올 수도 있습니다. 따라서 검사를 의뢰하기 전에 환자의 정확한 약물 복용력을 반드시 확인하는 것이 필수적입니다. 가장 이상적인 것은 항응고제의 영향이 없는 시점(예: 약물 중단 후 충분한 시간이 경과한 후)에 검사를 시행하는 것이지만, 임상적으로 이것이 불가능한 경우가 많습니다. 이런 경우에는, 검사실에서 헤파린 중화제(heparin neutralizer; 예: Polybrene 또는 Hepzyme)를 시약에 첨가하여 헤파린의 영향을 제거하는 방법을 사용하거나, 특정 항응고제의 영향을 상대적으로 덜 받는 것으로 알려진 검사법(예: Taipan snake venom time 등, 아직 널리 쓰이지는 않음)을 선택하거나, 혹은 환자의 혈중 약물 농도를 직접 측정하여 그 영향을 고려하여 결과를 해석하는 등의 노력이 필요합니다. 특히 DOACs의 경우, 검사에 미치는 영향이 약물 종류와 농도에 따라 매우 다양하고 예측하기 어려우므로 결과 해석에 극도의 주의가 요구됩니다.
일시적인 LA 양성 가능성 고려 및 반복 검사의 중요성
앞서 언급했듯이, 특정 감염(특히 바이러스 감염)이나 약물 반응 등에 의해 루푸스 항응고인자가 일시적으로(transiently) 나타났다가 수 주 또는 수 개월 내에 저절로 사라지는 경우가 드물지 않습니다. 이러한 일시적인 LA는 장기적인 혈전증 위험 증가와는 관련이 적을 수 있습니다. 따라서 항인지질항체증후군(APS)의 진단 기준을 충족하기 위해서는, 처음 LA 양성 결과가 나온 시점으로부터 최소 12주 이상의 충분한 간격(interval)을 두고 시행한 반복 검사에서도 LA 양성 소견이 지속적으로 확인되어야만 합니다 [4, 5]. 단 한 번의 LA 양성 결과만으로는 APS를 확진할 수 없으며, 반드시 시간 간격을 둔 재검사를 통해 항체의 지속성(persistence)을 입증해야 합니다.
다른 응고 이상과의 감별 진단 필요성
드물지만, 특정 응고 인자(특히 Factor VIII, Factor V, Factor II 등)에 대한 특이적인 자가항체 억제제(specific factor inhibitor)도 LA와 유사하게 응고 시간을 연장시키고 혼합 검사에서 교정되지 않는 소견을 보일 수 있습니다. 하지만 이러한 특이 억제제들은 확증 검사에서 인지질 의존성을 보이지 않으며, 종종 심각한 출혈 경향을 동반한다는 점에서 LA와 감별됩니다. 또한, 선천성 또는 후천성 응고 인자 결핍증이나 비타민 K 결핍 등 다른 혈액 응고 이상 질환과의 감별도 필요할 수 있습니다.
검사실 간의 결과 변이 가능성 인지
루푸스 항응고인자 검사는 그 복잡성으로 인해 완벽한 표준화가 매우 어렵습니다. 사용하는 검사 장비, 시약 제조사, 시약의 로트(lot) 번호, 그리고 검사실 자체의 숙련도 및 내부 정도관리 수준에 따라 결과값이나 결과 판정 기준치(cut-off value)가 검사실마다 다를 수 있습니다. 따라서 LA 검사 결과를 해석할 때는 반드시 해당 검사를 수행한 검사실에서 사용하는 참조 범위(reference range)와 양성 판정 기준치를 명확히 확인하고 이를 기반으로 판단해야 합니다. 다른 검사실의 기준을 임의로 적용해서는 안 됩니다.
이처럼 루푸스 항응고인자 검사는 단순히 검사를 시행하는 것뿐만 아니라, 그 결과를 정확하게 해석하고 임상적 의미를 부여하는 과정에서도 고도의 전문성과 신중함이 요구되는 분야입니다. 하지만 이러한 복잡하고 체계적인 접근법을 충실히 따름으로써 LA의 존재를 신뢰성 있게 진단하는 것은, 잠재적으로 심각한 혈전증이나 임신 합병증의 위험을 안고 있는 환자들을 조기에 발견하고, 그들의 예후를 개선하며, 가장 적절한 예방 및 치료 전략을 수립하는 데 있어 필수 불가결한 과정이라고 할 수 있습니다.
역설을 넘어선 이해 정확한 진단과 관리의 중요성
우리는 지금까지 루푸스 항응고인자(Lupus Anticoagulant, LA)라는 매우 독특하고 역설적인 이름 뒤에 숨겨진 복잡한 실체와 그 임상적 중요성에 대해 심층적으로 탐구하는 여정을 함께 했습니다. 이 긴 논의의 끝에서, 우리가 반드시 기억해야 할 핵심적인 내용들을 다시 한번 명확하게 정리해 보겠습니다.
첫째, LA는 그 이름이 주는 인상과는 완전히 반대로, 생리적인 혈액 응고 억제 물질이 결코 아니라는 사실입니다. 그 본질은 자신의 몸을 공격하는 자가항체이며, 구체적으로는 혈액 응고 과정에 필수적인 인지질 또는 인지질-결합 단백질(특히 베타-2 글리코프로테인 I, 프로트롬빈)을 표적으로 삼는 이질적인 항체 그룹을 통칭하는 용어입니다. '항응고인자'라는 이름은 순전히 시험관 내(in vitro)에서 특정 인지질 의존성 응고 검사 시간을 연장시키는 현상 때문에 붙여진 역사적 산물일 뿐입니다.
둘째, 이 시험관 내에서의 '항응고' 현상과는 정반대로, 실제 살아있는 몸속(in vivo)에서 LA는 혈관 내피세포, 혈소판, 단핵구 및 응고/항응고 시스템의 다양한 요소들과 복잡하게 상호작용하여 혈액 응고 경향을 비정상적으로 증가시키고, 결과적으로 동맥 및 정맥에 치명적인 혈전 생성을 촉진하는 강력한 위험 인자로 작용한다는 점입니다.
셋째, 이러한 임상적 중요성 때문에 LA는 항인지질항체증후군(APS)이라는 특정 자가면역 질환의 진단에 있어 항카디오리핀 항체(aCL), 항베타-2 글리코프로테인 I 항체(aβ2GPI)와 더불어 핵심적인 실험실 진단 기준 중 하나로 사용됩니다. APS는 반복적인 혈전증이나 심각한 임신 관련 합병증(반복 유산, 태아 사망, 조산 등)을 특징으로 하므로, LA의 존재 유무를 정확히 확인하는 것은 이러한 심각한 사건들의 근본 원인을 규명하고 재발을 방지하기 위한 치료 전략 수립의 결정적인 첫걸음이 됩니다.
넷째, 하지만 LA를 검사실에서 진단하는 과정은 단일 검사로는 불가능하며, 반드시 국제적으로 표준화된 다단계 접근법을 따라야 합니다. 이 과정은 (1) 인지질 의존성 응고 시간의 연장을 확인하는 선별 검사, (2) 응고 인자 결핍이 아닌 억제 물질의 존재를 증명하는 혼합 검사, 그리고 (3) 그 억제 물질이 인지질에 의존하여 작용함을 최종적으로 확증하는 확증 검사라는 세 가지 논리적인 단계를 포함합니다. 또한 검출률을 높이기 위해 최소 2가지 이상의 다른 원리에 기반한 검사법(예: dRVVT와 aPTT 기반 검사)을 병행해야 하며, 항응고제 복용 여부와 같은 잠재적 간섭 요인을 신중하게 평가하고, APS 진단을 위해서는 최소 12주 간격을 둔 반복 검사를 통해 항체의 지속성을 확인하는 과정이 필수적입니다.
결론적으로, 루푸스 항응고인자라는 이름이 가진 역설적인 의미와, 그 이면에 숨겨진 혈전증 유발이라는 중대한 임상적 위험성을 정확하게 이해하는 것이 무엇보다 중요합니다. 더불어, 비록 복잡하고 까다롭지만 표준화된 검사 절차를 충실히 따름으로써 LA의 존재를 신뢰성 있게 진단하고, 그 결과를 환자의 임상 소견 및 다른 항인지질항체 검사 결과와 종합적으로 판단하는 것이야말로, 항인지질항체증후군 환자들을 조기에 정확하게 진단하여 치명적인 혈전증이나 비극적인 임신 합병증의 위험으로부터 보호하고, 그들의 장기적인 건강과 삶의 질을 향상시키기 위한 최적의 관리 계획을 수립하는 데 있어 절대적으로 필수적인 과정임을 반드시 명심해야 할 것입니다.
참고문헌
[1] Galli, M., & Borrelli, G. (2020). Lupus Anticoagulant. In StatPearls. StatPearls Publishing. Available from: https://www.ncbi.nlm.nih.gov/books/NBK560576/
[2] McNeil, H. P., Simpson, R. J., Chesterman, C. N., & Krilis, S. A. (1990). Anti-phospholipid antibodies are directed against a complex antigen that includes a lipid-binding inhibitor of coagulation: beta 2-glycoprotein I (apolipoprotein H). Proceedings of the National Academy of Sciences of the United States of America, 87(11), 4120–4124.
[3] Love, P. E., & Santoro, S. A. (1990). Antiphospholipid antibodies: anticardiolipin and the lupus anticoagulant in systemic lupus erythematosus (SLE) and in non-SLE disorders. Prevalence and clinical significance. Annals of Internal Medicine, 112(9), 682–698.
[4] Miyakis, S., Lockshin, M. D., Atsumi, T., Branch, D. W., Brey, R. L., Cervera, R., ... & Koike, T. (2006). International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). Journal of Thrombosis and Haemostasis, 4(2), 295–306.
[5] Tektonidou, M. G., Andreoli, L., Limper, M., Amoura, Z., Cervera, R., Costedoat-Chalumeau, N., ... & Tincani, A. (2019). EULAR recommendations for the management of antiphospholipid syndrome in adults. Annals of the Rheumatic Diseases, 78(10), 1296–1304.
[6] Meroni, P. L., Borghi, M. O., Raschi, E., & Tedesco, F. (2011). Pathogenesis of antiphospholipid syndrome: understanding the antibodies. Nature Reviews Rheumatology, 7(6), 330–339.
[7] Pengo, V., Tripodi, A., Reber, G., Rand, J. H., Ortel, T. L., Galli, M., & De Groot, P. G. (2009). Update of the guidelines for lupus anticoagulant detection. Subcommittee on Lupus Anticoagulant/Antiphospholipid Antibody of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. Journal of Thrombosis and Haemostasis, 7(10), 1737–1740. (Note: While influential, superseded by 2020 update below)
[8] Clinical and Laboratory Standards Institute (CLSI). (2014). Laboratory Testing for the Lupus Anticoagulant; Approved Guideline. CLSI document H60-A. Clinical and Laboratory Standards Institute, Wayne, PA.
[9] Devreese, K. M. J., Ortel, T. L., & Mackie, I. (2020). ISTH communication. Subcommittee on Lupus Anticoagulant/Phospholipid Antibodies. Update of the ISTH guidelines for lupus anticoagulant detection. Journal of Thrombosis and Haemostasis, 18(11), 2828-2839. (Most current ISTH guideline update)
[10] Galli, M., Luciani, D., Bertolini, G., & Barbui, T. (2003). Lupus anticoagulants are stronger risk factors for thrombosis than anticardiolipin antibodies in the antiphospholipid syndrome: a systematic review of the literature. Blood, 101(5), 1827–1832.
'진단혈액' 카테고리의 다른 글
| CBC 장비에서 Bull's algorithm 의미와 적용 방법 (0) | 2025.04.09 |
|---|---|
| 진공 채혈관의 종류와 올바른 채혈 순서 (1) | 2025.04.08 |
| QC 물질 제조, Eppendorf pipette vs Volumetric pipette, 어떤 것을 선택할 것인가 (1) | 2025.04.06 |
| 비정상적으로 높은 MCHC의 원인과 해결책은? (0) | 2025.04.06 |




댓글