혹시 병원에서 검사를 받으시면서 혈액이나 소변 같은 검체를 제출해보신 경험, 다들 있으실 겁니다. 그런데 혹시 이런 생각해 보신 적 있으신가요? 내가 제출한 이 작은 검체 한 병이 어떤 과정을 거쳐 내 건강 상태에 대한 중요한 정보를 알려주는 걸까? 특히 그 안에 살고 있을지도 모르는, 눈에 보이지 않는 작은 생명체, 즉 미생물을 찾아내는 과정은 어떻게 이루어지는 걸까요?

아마 많은 분들이 검사실에서 뭔가 복잡한 기계로 분석하겠거니 막연하게 생각하실 텐데요, 사실 그 이전에 매우 중요하고 섬세한 과정이 숨어있습니다. 바로 미생물 검체를 안전하게 실험실까지 옮기고(운송), 그 안에 있는 미생물을 잘 자랄 수 있는 환경에 심어주는(접종) 과정입니다. 이번 시간에는 바로 이 미생물 검체의 운송 및 접종 과정에 대해 아주 깊이 있게 파헤쳐 보겠습니다.
미생물 검체, 왜 제대로 다뤄야 할까요?
가장 먼저, 미생물 검체를 왜 이렇게까지 신경 써서 다루어야 하는지에 대한 근본적인 이유부터 확실히 짚고 넘어가야 합니다. 앞서 잠시 언급했듯이, 미생물 검체는 살아있는 생명체를 포함하고 있으며, 검사 결과의 정확성은 검체 채취부터 운송, 접종에 이르는 모든 과정의 품질에 의해 결정되기 때문입니다. 이는 아무리 강조해도 지나치지 않은데요, 만약 이 과정 중 어느 한 단계에서라도 문제가 발생한다면, 최종적으로 얻게 되는 검사 결과는 실제 환자의 상태를 전혀 반영하지 못하는, 그야말로 ‘쓰레기’ 데이터가 될 수 있습니다.
상상해 보세요. 폐렴이 의심되는 환자의 객담(가래) 검체를 받았는데, 운송 중에 오염되어 폐렴의 원인균이 아닌 전혀 엉뚱한 세균만 잔뜩 자랐다고 가정해 봅시다. 검사 결과만 보면 의사는 엉뚱한 세균에 맞는 항생제를 처방하게 될 것이고, 실제 원인균은 계속 환자의 몸속에서 증식하며 병을 악화시키겠지요. 이는 단순한 실수가 아니라 환자의 생명과 직결될 수 있는 매우 심각한 문제입니다.
그렇다면 ‘제대로 다룬다’는 것은 구체적으로 무엇을 의미할까요? 이를 이해하기 위해서는 먼저 미생물과 검체라는 기본적인 개념부터 알아야 합니다. 미생물(Microorganism)이란 말 그대로 우리 눈에 보이지 않을 정도로 작은 생명체를 통칭하는 말입니다. 여기에는 세균(Bacteria), 바이러스(Virus), 진균(Fungi, 곰팡이나 효모), 기생충(Parasite) 등이 포함되지요.

이들은 우리 주변 환경 어디에나 존재하며, 우리 몸속에도 정상적으로 살아가고 있는 종류(정상 균총, Normal flora)도 있지만, 특정 부위에 침입하여 질병을 일으키는 병원성 미생물도 있습니다. 우리가 미생물 검사를 하는 주된 목적은 바로 이 병원성 미생물을 찾아내고, 어떤 종류인지 정확히 밝혀(동정), 어떤 치료제(예: 항생제)에 잘 듣는지(감수성 검사) 알아내기 위함입니다.
검체(Specimen)란 이러한 미생물의 존재 여부를 확인하기 위해 환자로부터 채취하는 모든 종류의 생물학적 물질을 의미합니다. 예를 들면 혈액(Blood), 소변(Urine), 객담(Sputum), 대변(Stool), 뇌척수액(CSF, Cerebrospinal fluid), 고름(Pus), 조직(Tissue), 면봉으로 채취한 분비물(Swab sample) 등이 모두 검체에 해당합니다. 어떤 질병이 의심되느냐에 따라 채취하는 검체의 종류가 달라지겠지요. 예를 들어 요로 감염이 의심되면 소변 검체를, 폐렴이 의심되면 객담 검체를, 뇌수막염이 의심되면 뇌척수액 검체를 채취하는 식입니다.
자, 이제 왜 검체를 제대로 다루는 것이 중요한지 구체적인 이유를 살펴볼까요? 크게 세 가지 측면에서 그 중요성을 강조할 수 있습니다.
첫째, 검체 내 목표 미생물의 생존력 유지입니다. 검사 대상이 되는 미생물은 검체 채취 시점부터 실험실에서 분석될 때까지 살아있는 상태를 유지해야 합니다. 만약 운송이나 보관 과정에서 목표 미생물이 죽어버린다면, 실제로는 감염이 존재함에도 불구하고 검사 결과는 ‘음성’으로 나오는 위음성(False negative) 결과를 초래할 수 있습니다.
특히 일부 미생물은 환경 변화에 매우 취약해서, 온도 변화나 건조한 환경, 산소 노출 등에 의해 쉽게 사멸할 수 있습니다. 예를 들어 임질의 원인균인 Neisseria gonorrhoeae*나 뇌수막염의 원인균 중 하나인 *Neisseria meningitidis 같은 세균은 낮은 온도나 건조한 환경에 매우 약해서, 검체를 냉장 보관하거나 운송이 지연되면 쉽게 죽어버릴 수 있습니다. 따라서 이러한 미생물이 의심될 때는 반드시 적절한 온도(주로 상온)를 유지하고 최대한 신속하게 운송해야 하는 것이지요.
둘째, 검체 내 미생물의 과증식 방지입니다. 반대로, 운송이나 보관 중에 검체 내 미생물이 과도하게 증식하는 것도 심각한 문제를 일으킵니다. 특히 검체에는 원래 목표 미생물 외에도 다양한 종류의 다른 미생물들(정상 균총이나 오염균)이 함께 존재할 수 있습니다. 만약 검체를 부적절하게 상온에 오래 방치하면, 이러한 배경 미생물들이 목표 미생물보다 훨씬 빠르게 증식하여 원래의 균 분포 비율을 왜곡시킬 수 있습니다.
예를 들어 소변 검체의 경우, 채취 후 상온에 2시간 이상 방치하면 원래 요도 주변에 있던 정상 균총들이 급격히 증식하여 실제 요로 감염의 원인균 수를 정확히 파악하기 어렵게 만들 수 있습니다. 이는 마치 범죄 현장에서 범인의 발자국(목표 미생물) 위에 다른 사람들의 발자국(배경 미생물)이 마구 찍혀 범인을 특정하기 어려워지는 상황과 비슷하다고 할 수 있습니다. 따라서 적절한 온도(주로 냉장)에서 보관하여 미생물의 증식을 억제하는 것이 매우 중요합니다.
셋째, 검체 오염 방지입니다. 검체는 채취, 운송, 접종의 모든 과정에서 외부 미생물에 의한 오염(Contamination)을 철저히 방지해야 합니다. 만약 검체 채취 시 피부 소독이 제대로 이루어지지 않았거나, 운송 용기가 멸균되지 않았거나, 접종 과정에서 공기 중의 미생물이 혼입된다면, 실제 환자에게는 없는 미생물이 검사 결과에 나타나는 위양성(False positive) 결과를 초래할 수 있습니다.
예를 들어 혈액 배양 검사 시 피부 소독이 부적절하면 피부 상재균(예: Staphylococcus epidermidis)이 혈액과 함께 배양 병으로 들어가 자랄 수 있는데, 이를 실제 균혈증(Bacteremia)으로 오인하여 불필요한 항생제 치료를 하게 만들 수 있습니다. 이는 환자에게 불필요한 고통과 비용을 안겨줄 뿐만 아니라, 항생제 내성 문제까지 유발할 수 있는 심각한 결과를 낳습니다. 따라서 멸균된 용기와 도구를 사용하고, 철저한 무균 조작(Aseptic technique)을 준수하는 것이 필수적입니다.
이처럼 미생물 검체를 제대로 다루는 것은 정확한 진단을 내리고, 적절한 치료법을 결정하며, 나아가 감염병의 확산을 막는 역학 조사나 새로운 치료제 개발 연구 등 공중 보건 및 의학 연구 전반에 걸쳐 엄청난 영향을 미칩니다. 그렇다면 구체적으로 어떻게 운송하고 접종해야 할까요? 이제부터 그 상세한 방법과 원리를 하나씩 파헤쳐 보겠습니다.
검체 운송 : 시간과 온도와의 싸움
미생물 검체 운송의 핵심 목표는 단 하나, 검체가 채취된 시점의 상태를 최대한 그대로 유지하여 실험실까지 안전하게 전달하는 것입니다. 이를 위해서는 앞서 강조했듯이 목표 미생물의 생존은 보장하되 불필요한 증식이나 사멸은 최소화해야 하며, 외부로부터의 오염은 완벽하게 차단해야 합니다. 마치 살아있는 생물을 아주 조심스럽게, 최적의 환경을 유지하며 목적지까지 옮기는 것과 같다고 생각하시면 이해가 쉬울 것입니다.
이 과정에서 가장 중요하게 고려해야 할 요소는 바로 운송 용기, 온도, 그리고 시간입니다. 이 세 가지 요소는 서로 밀접하게 연관되어 있으며, 어느 하나라도 소홀히 하면 검체의 품질에 치명적인 영향을 미칠 수 있습니다. 자, 그럼 각각의 요소에 대해 좀 더 자세히 알아볼까요?
운송 용기 : 미생물의 안전한 집
검체 운송 용기는 검체를 외부 환경으로부터 보호하고 내부 상태를 안정적으로 유지하는 가장 기본적인 도구이자, 미생물의 안전한 '집' 역할을 합니다. 여러분이 병원에서 소변 검사를 위해 받았던 플라스틱 컵이나, 피를 뽑을 때 사용했던 진공 채혈관 등을 떠올려 보시면 됩니다. 이러한 용기들이 단순한 플라스틱 통이나 유리병처럼 보일지 몰라도, 사실은 미생물 검체의 품질 유지를 위해 몇 가지 중요한 조건을 충족하도록 설계되어 있습니다.

가장 기본적으로, 모든 운송 용기는 반드시 멸균(Sterile) 상태여야 합니다. 이는 외부 미생물에 의한 검체 오염을 방지하기 위한 가장 첫 번째 단계입니다. 만약 용기 자체가 오염되어 있다면, 아무리 검체를 조심스럽게 채취하고 운송한다 해도 이미 시작부터 잘못된 것이지요.
또한, 용기는 견고하고 파손의 위험이 적어야 하며, 내용물이 외부로 새어 나오지 않도록 완벽하게 밀폐(Leak-proof)될 수 있어야 합니다. 운송 중 충격으로 용기가 깨지거나 뚜껑이 열려 검체가 유출된다면, 검사 결과를 얻을 수 없을 뿐만 아니라 주변 환경을 오염시키고 감염의 위험까지 초래할 수 있기 때문입니다.
용기의 크기 또한 중요합니다. 검체의 양에 비해 너무 크거나 작은 용기는 부적절합니다. 너무 큰 용기는 검체가 용기 벽에 넓게 퍼져 건조되기 쉬울 수 있고, 너무 작은 용기는 채취나 운송 중 넘칠 위험이 있습니다. 따라서 예상되는 검체의 양에 맞는 적절한 크기의 용기를 선택해야 합니다.
아니, 그냥 깨끗한 플라스틱 통 아무거나 쓰면 안 돼? 뭘 그렇게까지 까다롭게 굴어?
이렇게 생각하실 수도 있습니다. 하지만 앞서 말씀드렸듯이, 미생물 검체는 매우 민감하며, 사소해 보이는 차이가 결과에 큰 영향을 미칠 수 있습니다. 일반 플라스틱 통은 멸균 상태를 보장할 수 없고, 밀폐성이 떨어지거나 재질 자체가 미생물 생존에 영향을 줄 수도 있습니다. 특히 특정 미생물을 검사하기 위해서는 더욱 특수한 기능이 추가된 운송 용기가 필요합니다.
예를 들어, 면봉(Swab)으로 목이나 상처 부위 등에서 검체를 채취하는 경우에는 단순히 마른 면봉만 사용하지 않습니다. 면봉을 담는 튜브 안에는 수송 배지(Transport media)라는 특수한 액체나 젤이 들어있는 경우가 많습니다. 이 수송 배지는 미생물이 즉시 자라지는 못하도록 영양분은 최소화하면서도, 미생물이 죽지 않고 살아있는 상태를 유지할 수 있도록 삼투압과 pH를 적절히 조절해주고 건조를 방지하는 역할을 합니다.
또한, 일부 수송 배지에는 목표 미생물 외의 다른 잡균의 성장을 억제하는 항생제가 첨가되어 있기도 합니다. 즉, 수송 배지는 검체가 실험실에 도착할 때까지 미생물의 생존율을 높이고 원래 상태를 최대한 보존하기 위한 '생명 유지 장치'와 같은 역할을 하는 셈입니다. 대표적인 예로 Stuart 배지, Amies 배지, Cary-Blair 배지 등이 있으며, 검체 종류나 의심되는 미생물에 따라 적절한 수송 배지를 선택해야 합니다.
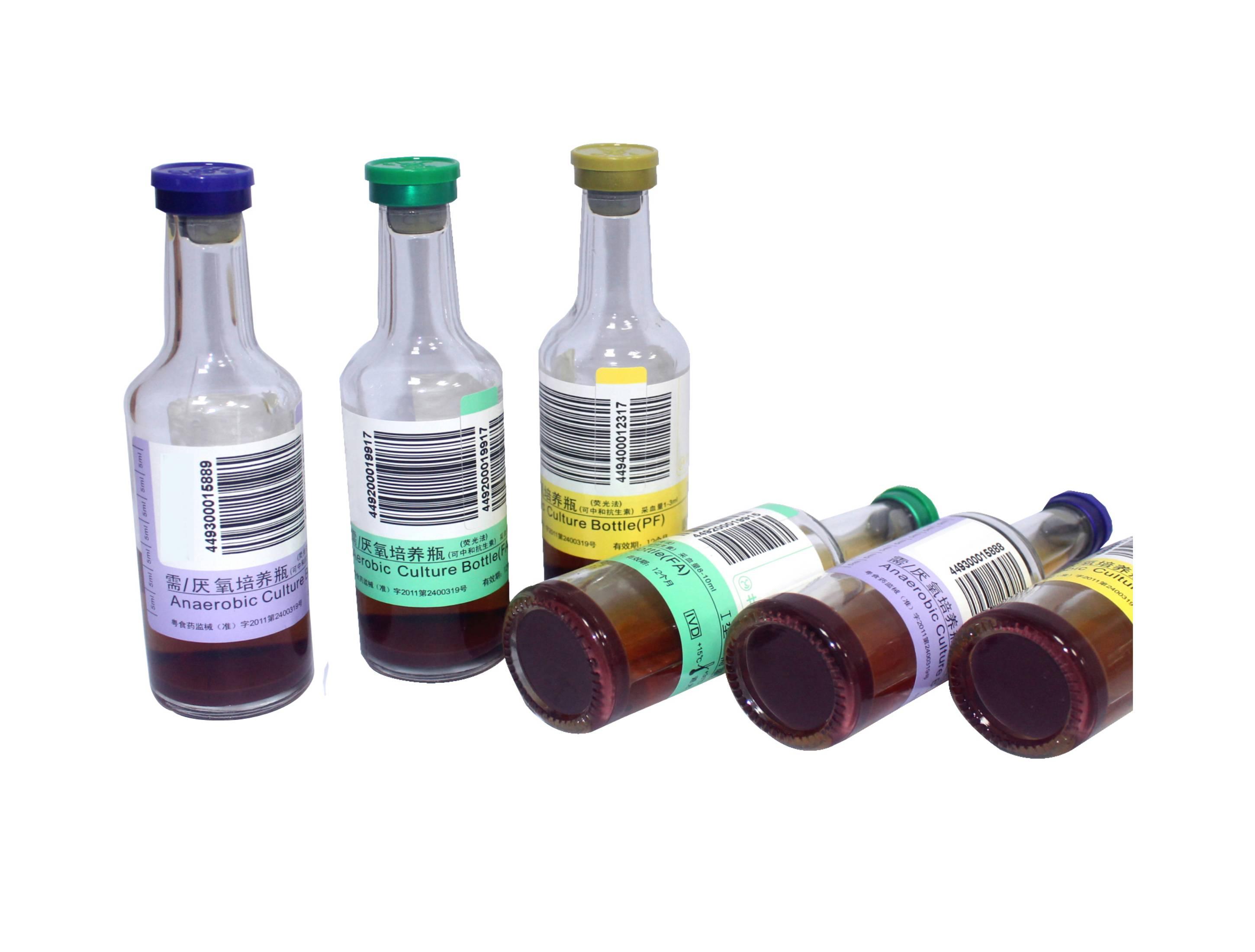
혈액 배양 검사의 경우에는 더욱 특수한 혈액 배양 병(Blood culture bottle)을 사용합니다. 이 병 안에는 미생물이 자랄 수 있는 영양분이 풍부한 액체 배지가 들어 있으며, 혈액 내 항생제 성분을 중화시키는 물질(예: SPS - Sodium polyanethol sulfonate)이나 항응고제가 첨가되어 있기도 합니다. 또한, 산소를 좋아하는 호기성균(Aerobic bacteria)과 산소를 싫어하는 혐기성균(Anaerobic bacteria)을 모두 검출하기 위해 각각 다른 종류의 배양 병(호기성 병, 혐기성 병)에 혈액을 나누어 접종하는 것이 일반적입니다.
소변 검체는 보통 멸균된 넓은 입구의 플라스틱 컵에 채취하지만, 운송 시간이 길어질 것으로 예상되는 경우에는 보존제(Preservative)가 포함된 특수 소변 용기를 사용하기도 합니다. 이 보존제는 소변 내 세균의 증식을 억제하여 검체 채취 후 최대 24~48시간까지 냉장 보관 없이도 검체의 상태를 유지하는 데 도움을 줍니다.
이 외에도 산소에 노출되면 즉시 사멸하는 혐기성균을 위한 혐기성 수송 배지(Anaerobic transport media)나 용기, 바이러스 검사를 위한 바이러스 수송 배지(VTM, Viral Transport Medium) 등 검사 목적과 대상 미생물의 특성에 따라 매우 다양한 종류의 특수 운송 용기들이 사용됩니다.

따라서 어떤 검사를 위해 어떤 종류의 검체를 채취하는지에 따라 반드시 그에 맞는 적절한 운송 용기를 선택하고 올바르게 사용하는 것이 검체 품질 유지의 첫걸음이라고 할 수 있습니다.
| 주요 검체 종류 | 권장 운송 용기 예시 | 비고 |
|---|---|---|
| 혈액 (Blood) | 혈액 배양 병 (호기성/혐기성), 항응고제 튜브 (EDTA, Heparin 등 - 분자 진단용) | 혈액 배양 병은 절대 냉장/냉동 금지. |
| 소변 (Urine) | 멸균 컵, 보존제 함유 튜브 (운송 지연 시) | 채취 후 2시간 내 처리 불가 시 냉장 보관 또는 보존제 튜브 사용. |
| * 객담 (Sputum) | 멸균된 넓은 입구의 용기 (예: 멸균 객담통) | 타액(침)이 아닌 폐 깊숙한 곳의 객담 채취 중요. |
| * 대변 (Stool) | 멸균 용기, 수송 배지 (Cary-Blair 등 - 세균 배양 시), 보존제 용기 (기생충 검사 시) | 검사 목적에 따라 용기 선택. |
| * 뇌척수액 (CSF) | 멸균 튜브 (보통 3-4개로 나누어 채취) | 채취 즉시 실험실로 운송 (상온). 절대로 냉장 금지 (일부 세균 사멸). |
| * 면봉 검체 (Swab) | 수송 배지 (Stuart, Amies 등)가 포함된 튜브, 혐기성 수송 배지 (혐기성균 의심 시) | 건조 방지 중요. 검체 부위 및 의심 균종에 따라 배지 선택. |
| * 조직 (Tissue) | 멸균 용기 (생리식염수 약간 적셔 건조 방지), 특수 배지 (필요시) | 분쇄 등 전처리 필요할 수 있음. |
| * 바이러스 검체 | 바이러스 수송 배지 (VTM) | 냉장 또는 냉동 운송 (검사 종류에 따라). |
이 표는 일반적인 예를 보여주는 것이며, 실제로는 각 의료기관이나 검사기관의 지침에 따라 구체적인 용기 선택이 달라질 수 있음을 반드시 기억해야 합니다.
온도: 미생물의 생사를 가르는 결정적 요인
운송 용기만큼이나, 아니 어쩌면 그보다 더 중요하다고 할 수 있는 것이 바로 운송 중 온도 관리입니다. 왜냐하면 온도는 미생물의 생존과 증식 속도에 직접적인 영향을 미치는 가장 결정적인 환경 요인 중 하나이기 때문입니다. 대부분의 병원성 미생물은 특정 온도 범위 내에서만 생존하거나 안정적으로 유지될 수 있습니다. 따라서 검체 종류와 검사 목적, 그리고 의심되는 미생물의 종류에 따라 최적의 운송 온도를 선택하고 이를 철저히 유지하는 것이 극도로 중요합니다. 만약 온도가 너무 높거나 낮으면, 미생물이 죽거나 과도하게 증식하여 검사 결과를 완전히 왜곡시킬 수 있습니다.
그렇다면 어떤 온도로 운송해야 할까요? 일반적으로 미생물 검체 운송에 사용되는 온도 조건은 크게 세 가지로 나눌 수 있습니다. 상온(Room temperature, 보통 15-25°C), 냉장(Refrigeration, 2-8°C), 그리고 냉동(Freezing, -20°C 이하 또는 -70°C 이하)입니다. 각각의 온도 조건이 왜 필요하고, 어떤 검체에 적용되는지 자세히 살펴보겠습니다.
먼저 상온 운송입니다. 의외라고 생각하실 수도 있습니다. 보통 검체를 신선하게 유지하려면 차갑게 보관해야 할 것 같은데, 왜 상온에서 운송해야 하는 경우가 있을까요? 그 이유는 일부 미생물들이 낮은 온도에 매우 민감하여 냉장 보관 시 오히려 사멸하거나 생존력이 급격히 떨어지기 때문입니다. 대표적인 예가 앞서 언급했던 임질균(Neisseria gonorrhoeae)이나 수막구균(Neisseria meningitidis)입니다. 이 균들은 체온과 비슷한 온도에서 잘 자라지만, 냉장 온도에서는 생존하기 어렵습니다.
따라서 이러한 균들이 의심되는 검체(예: 요도 분비물, 뇌척수액 등)는 절대로 냉장 보관해서는 안 되며, 반드시 상온에서 최대한 신속하게 운송해야 합니다. 또한, 혈액 배양 검체 역시 일반적으로 상온에서 운송하는 것이 원칙입니다. 혈액 배양 병 내의 배지는 미생물 증식을 위한 것이므로, 냉장 시 균의 성장이 억제되어 검출이 지연될 수 있기 때문입니다. 또한, 혈액 내에는 보체(Complement)와 같은 항균 성분이 있는데, 냉장 상태에서는 이러한 성분의 활성이 유지되어 미생물 생존에 불리할 수 있다는 보고도 있습니다 [1].
다음으로 냉장 운송(2-8°C)입니다. 이것이 아마도 가장 흔하게 사용되는 미생물 검체 운송 온도일 것입니다. 대부분의 세균 배양 검체, 예를 들어 소변, 객담, 대변, 상처 분비물(면봉 검체) 등은 냉장 상태로 운송하는 것이 권장됩니다. 왜 그럴까요? 냉장 온도는 대부분의 미생물 증식 속도를 현저히 늦추는 효과가 있기 때문입니다. 앞서 설명했듯이, 검체 내에는 목표 미생물 외에도 다양한 정상 균총이나 오염균이 존재할 수 있는데, 상온에 방치하면 이들이 과도하게 증식하여 검사 결과를 왜곡시킬 수 있습니다.
냉장 보관은 이러한 불필요한 미생물의 증식을 효과적으로 억제하여, 검체 채취 시점의 미생물 상태를 비교적 안정적으로 유지시켜 줍니다. 또한, 낮은 온도는 검체 자체의 변성(예: 효소 활성 변화, 세포 파괴 등)을 방지하는 데도 도움이 됩니다. 바이러스 검체 역시 대부분 냉장 상태로 운송하는 것이 일반적입니다. 하지만 명심해야 할 것은, 냉장이 미생물을 죽이는 것이 아니라 단지 증식을 억제하는 것이라는 점입니다. 따라서 냉장 보관 중에도 시간이 너무 오래 지연되면 미생물이 서서히 사멸하거나 변성될 수 있으므로, 여전히 신속한 운송이 중요합니다.
마지막으로 냉동 운송(-20°C 이하 또는 -70°C 이하)입니다. 냉동은 주로 검체를 장기간 보관해야 하거나, 특정 종류의 검사(특히 분자 진단 검사)를 위해 검체 내 핵산(DNA 또는 RNA)의 안정성을 유지해야 할 때 필요합니다. 예를 들어, 바이러스의 유전자를 증폭하여 검출하는 PCR(Polymerase Chain Reaction) 검사를 위해서는 바이러스 입자 자체의 생존 여부보다는 그 안에 있는 RNA나 DNA가 분해되지 않고 온전하게 보존되는 것이 더 중요합니다. 낮은 온도는 핵산을 분해하는 효소(Nuclease)의 활성을 억제하여 핵산의 안정성을 높여줍니다.
일부 특수한 바이러스 배양 검사나 특정 혈청학적 검사를 위해서도 냉동 보관이 요구될 수 있습니다. 하지만 주의해야 할 점은, 모든 검체를 냉동할 수 있는 것은 아니라는 사실입니다. 특히 세균 배양을 목적으로 하는 검체는 절대로 냉동해서는 안 됩니다. 냉동 과정에서 얼음 결정이 형성되면서 세균 세포벽이나 세포막이 파괴되어 미생물이 사멸할 수 있기 때문입니다. 또한, 동결과 융해를 반복하는 것은 검체 품질에 더욱 치명적인 손상을 줄 수 있으므로 반드시 피해야 합니다. 한번 냉동된 검체는 해동 후 즉시 사용해야 하며, 다시 냉동해서는 안 됩니다.
그럼 그냥 무조건 냉장이나 냉동하면 안전한 거 아니야? 상온은 좀 불안한데.
절대로 그렇지 않습니다! 앞서 강조했듯이, 잘못된 온도 선택은 검체를 아예 못 쓰게 만들 수 있습니다. 상온 운송이 필요한 검체를 냉장하면 목표 미생물이 죽어 위음성 결과를 낳을 수 있고, 반대로 냉장이 필요한 검체를 상온에 방치하면 잡균 증식으로 위양성 또는 부정확한 결과를 초래할 수 있습니다. 핵심은 검체 종류와 검사 목적에 맞는 '최적의' 온도를 선택하고, 운송 전 과정 동안 그 온도를 일정하게 유지하는 것입니다. 이를 위해 단열 처리된 운송 상자, 냉매(아이스팩, 드라이아이스), 온도 기록 장치 등을 활용하여 운송 중 온도 변화를 최소화하려는 노력이 필요합니다.
| 운송 온도 | 일반적인 온도 범위 | 주요 적용 검체 예시 | 목적 및 이유 | 주의사항 |
|---|---|---|---|---|
| 상온 | 15-25°C | 혈액 배양 병, 뇌척수액(CSF) 세균 검사, N. gonorrhoeae, N. meningitidis 등 특정 세균 의심 검체, 일부 진균 검체 | 낮은 온도에 민감한 미생물의 생존 유지, 혈액 배양 시 증식 촉진 | 냉장/냉동 절대 금지! 신속 운송 필수. |
| 냉장 | 2-8°C | 소변, 객담, 대변, 상처/면봉 검체 (대부분의 세균 배양), 바이러스 검체 (VTM), 대부분의 혈청 검체 | 미생물 증식 억제 (과증식 방지), 검체 변성 방지, 바이러스 안정성 유지 | 상온 운송 필요한 검체(위 참조)는 냉장 금지. 장시간 보관 시 미생물 사멸 가능성 있음. |
| 냉동 | -20°C 이하 또는 -70°C 이하 | 분자 진단 검사용 검체 (PCR 등 - 핵산 안정성 유지), 장기 보관 필요 검체, 특정 바이러스/혈청 검사 | 핵산 분해 효소 활성 억제, 장기간 안정성 확보 | 세균 배양 목적 검체 절대 냉동 금지 (세포 파괴). 동결-융해 반복 금지. 검체 종류 및 검사법에 따라 적정 냉동 온도 확인 필요 (-20°C vs -70°C). |
이 표는 일반적인 권장 사항이며, 검사 항목이나 기관의 지침에 따라 달라질 수 있으므로 항상 해당 규정을 확인하는 것이 중요합니다. 마치 각기 다른 식재료를 최상의 상태로 보관하기 위해 냉장고의 칸별 온도를 달리하거나 냉동실을 이용하는 것처럼, 미생물 검체 역시 그 종류와 목적에 맞는 최적의 온도 환경을 제공해주어야만 그 가치를 제대로 발휘할 수 있다는 사실을 명심해야 합니다.
시간: 신선도가 생명! 운송 시간의 중요성
온도 관리와 더불어 미생물 검체 운송에서 절대적으로 중요한 또 다른 요소는 바로 '시간'입니다. 아무리 적절한 용기에 담아 최적의 온도를 유지한다 하더라도, 검체가 채취된 후 실험실에 도착하기까지 너무 오랜 시간이 걸린다면 검체의 품질은 저하될 수밖에 없습니다. 검체는 채취 후 가능한 한 빨리, 정해진 시간 내에 실험실로 운송되어 처리되어야 합니다. 왜 시간이 이렇게 중요할까요?
시간이 지연될수록 검체 내에서는 여러 가지 바람직하지 않은 변화가 일어날 수 있습니다. 첫째, 목표 미생물이 사멸하거나 생존력이 감소할 수 있습니다. 특히 환경 변화에 민감한 미생물일수록 시간이 지남에 따라 생존율이 급격히 떨어질 수 있습니다. 둘째, 앞서 언급했듯이 배경 미생물(정상 균총 또는 오염균)이 증식하여 원래의 균 분포를 왜곡시키거나 목표 미생물의 검출을 방해할 수 있습니다. 셋째, 미생물의 대사 활동으로 인해 검체의 pH나 화학적 조성이 변화할 수 있으며, 이는 특정 검사 결과에 영향을 미칠 수 있습니다. 넷째, 검체 자체가 변성되거나 세포가 파괴될 수도 있습니다. 예를 들어 혈액 검체의 경우 시간이 오래되면 세포가 용혈(파괴)될 수 있고, 소변 검체에서는 세포나 결정체 등이 변형되거나 파괴될 수 있습니다.
마치 갓 잡은 신선한 생선과 시간이 오래 지나 상하기 시작한 생선의 차이를 생각해보면 이해하기 쉬울 것입니다. 신선한 생선으로는 맛있는 회를 즐길 수 있지만, 상한 생선으로는 아무리 좋은 양념을 해도 원래의 맛과 품질을 되돌릴 수 없으며 오히려 건강에 해로울 수 있습니다. 미생물 검체 역시 '신선도'가 생명이며, 시간이 지연될수록 검체의 정보 가치는 떨어지고 잘못된 결과를 초래할 위험은 커지는 것입니다.
그렇다면 얼마나 빨리 운송해야 할까요? 이는 검체의 종류와 보관 조건에 따라 다릅니다. 일반적으로는 채취 후 2시간 이내에 실험실에 도착하여 처리하는 것이 가장 이상적입니다. 하지만 현실적으로 모든 검체를 2시간 내에 운송하는 것은 어려울 수 있습니다. 따라서 각 검체 종류별로 허용 가능한 최대 운송 시간과 그 시간 동안의 적절한 보관 조건(온도)에 대한 가이드라인이 마련되어 있습니다.
예를 들어, 뇌척수액(CSF) 검체는 매우 응급한 검사이자 검체 내 미생물이 쉽게 변성되거나 사멸할 수 있으므로, 채취 즉시 상온 상태로 실험실에 전달하는 것이 원칙입니다. 지연은 절대로 허용되지 않습니다. 소변 검체의 경우, 채취 후 2시간 이내에 처리하는 것이 가장 좋지만, 만약 지연될 경우에는 반드시 냉장(2-8°C) 보관해야 하며, 이 경우 최대 24시간까지 보관이 가능하다고 알려져 있습니다 [2].
하지만 24시간을 넘기면 냉장 보관하더라도 결과의 신뢰도가 떨어질 수 있습니다. 객담 검체 역시 2시간 이내 처리가 이상적이며, 지연 시 냉장 보관해야 합니다. 혈액 배양 병은 앞서 말했듯이 상온에서 운송하며, 가능한 한 빨리 배양기에 넣는 것이 좋지만, 일반적으로 채취 후 24시간 이내에는 배양기에 투입되어야 합니다. 면봉 검체는 사용된 수송 배지의 종류에 따라 허용 시간이 달라질 수 있으므로, 해당 제품의 지침을 확인해야 합니다. 일반적으로는 냉장 보관 시 24~48시간 정도 유효한 경우가 많습니다.
이러한 시간 기준은 CLSI(Clinical and Laboratory Standards Institute) 와 같은 국제적으로 공신력 있는 기관에서 발표하는 가이드라인에 근거하는 경우가 많습니다. 예를 들어, CLSI의 M40 가이드라인은 미생물 수송 시스템의 품질 관리에 대한 표준을 제시하고 있으며, 여기에는 검체 종류별 권장 운송 시간 및 온도에 대한 정보가 포함되어 있습니다 [3]. 각 검사실은 이러한 국제 표준과 자체적인 검증 결과를 바탕으로 검체 운송 및 보관에 대한 구체적인 정책과 절차를 수립하고 이를 철저히 준수해야 합니다.
| 검체 종류 | 이상적인 처리 시간 | 지연 시 보관 조건 및 최대 허용 시간 (일반적 예시) | 비고 |
|---|---|---|---|
| 뇌척수액 (CSF) | 즉시 | 지연 절대 불가. 상온 운송. | 응급 검사. 냉장 금지. |
| 소변 (Urine) | 2시간 이내 | 냉장(2-8°C) 보관 시 최대 24시간. 보존제 튜브 사용 시 상온에서 24~48시간 가능 (제품별 확인). | 장시간 방치 시 세균 과증식. |
| 객담 (Sputum) | 2시간 이내 | 냉장(2-8°C) 보관 권장. | 구강 내 정상 균총 오염 및 증식 주의. |
| 혈액 배양 병 | 가능한 한 빨리 | 상온 운송. 일반적으로 24시간 이내 배양기 투입 권장. | 냉장/냉동 금지. |
| 면봉 검체 (Swab) | 2시간 이내 | 수송 배지 사용. 냉장(2-8°C) 보관 시 24~48시간 가능 (배지 종류 및 제조사 지침 확인). 특정 균(N. gonorrhoeae 등)은 상온 운송 및 즉시 처리 필요. | 건조 방지 중요. |
| 대변 (Stool) | 2시간 이내 | 세균 배양 시 냉장(2-8°C) 보관 또는 Cary-Blair 수송 배지 사용. 기생충 검사 시 보존제(PVA, Formalin 등) 사용 또는 즉시 검사. 바이러스 검사 시 냉장 또는 냉동. | 검사 목적에 따라 보관법 상이. 실온 방치 시 pH 변화 및 세균 사멸 가능성. |
다시 한번 강조하지만, 위의 표는 일반적인 지침이며 실제 적용 시에는 반드시 해당 기관의 구체적인 규정을 따라야 합니다. 중요한 것은 시간이 지체될수록 검사 결과의 신뢰도는 떨어진다는 사실을 명확히 인지하고, 검체 채취부터 실험실 접수까지의 시간을 최대한 단축시키려는 노력과 함께, 불가피한 지연 시에는 반드시 규정된 온도 조건을 철저히 준수해야 한다는 점입니다.
특수 검체의 운송: 까다로운 손님 맞이하기
지금까지 일반적인 검체 운송 원칙에 대해 살펴보았는데요, 몇몇 특별히 까다로운 손님들, 즉 특수한 조건에서만 생존하거나 안정성을 유지하는 미생물들을 위한 검체 운송은 더욱 세심한 주의가 필요합니다. 대표적인 예로 혐기성균, 바이러스, 특정 진균, 그리고 혈액 배양 검체 등을 들 수 있습니다. 이러한 검체들은 일반적인 운송 방법으로는 미생물이 사멸하거나 변성될 위험이 높아, 각각의 특성에 맞는 특수한 운송 방법과 용기, 온도 관리가 필수적입니다.
먼저 혐기성균(Anaerobic bacteria)입니다. 이들은 이름 그대로 산소(Oxygen)가 없는 환경에서만 살 수 있거나, 오히려 산소가 있으면 죽는 세균들을 말합니다. 우리 몸의 장 내부나 깊은 상처 부위 등 산소가 희박한 곳에서 감염을 일으키는 경우가 많습니다. 따라서 혐기성균 감염이 의심되는 검체(예: 농양, 심부 조직, 복수 등)를 채취하여 운송할 때는 검체가 공기 중의 산소에 노출되는 것을 최대한 막아야 합니다. 어떻게 이것이 가능할까요?
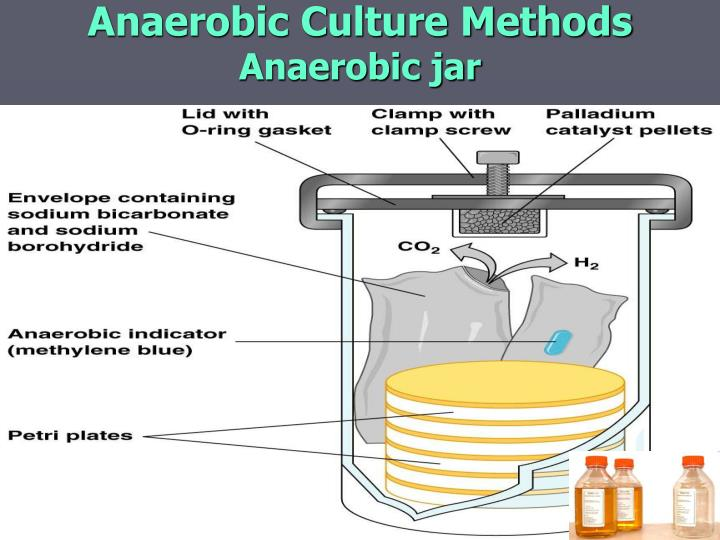
가장 중요한 것은 채취 즉시 산소 노출을 차단하는 것입니다. 주사기를 이용하여 농양 등에서 검체를 채취한 경우, 바늘 끝에 고무마개를 씌우거나 바늘을 구부려 공기 유입을 막은 채로 운송하는 방법이 있습니다. 또는 면봉으로 채취한 경우에는 혐기성 수송 배지(Anaerobic transport media)가 들어있는 특수 튜브를 사용해야 합니다. 이 배지 안에는 티오글리콜산염(Thioglycollate)과 같은 환원제(Reducing agent)가 들어 있어 용기 내에 남아있는 산소를 화학적으로 제거해주고, 레사주린(Resazurin)과 같은 산소 지시약(Oxygen indicator)이 포함되어 있어 산소가 유입되면 색깔이 변해(보통 분홍색) 용기의 상태를 확인할 수 있도록 해줍니다.
이러한 혐기성 운송 시스템을 이용하여 검체를 상온에서 최대한 빨리 실험실로 운송하는 것이 중요합니다. 절대로 냉장 보관해서는 안 되는데, 이는 낮은 온도에서는 산소의 용해도가 높아져 오히려 검체 내 산소 농도가 증가할 수 있기 때문입니다 [4].
다음은 바이러스(Virus) 검체입니다. 바이러스는 세균과 달리 스스로 증식할 수 없고 살아있는 세포 내에서만 증식하는 특징을 가집니다. 따라서 바이러스 검사의 목적은 크게 바이러스 자체를 분리/배양하거나(고전적인 방법), 바이러스의 특정 단백질(항원)을 검출하거나, 또는 바이러스의 유전물질(DNA 또는 RNA)을 검출하는(분자 진단) 것으로 나뉩니다. 어떤 검사를 하느냐에 따라 운송 조건이 달라질 수 있지만, 일반적으로 바이러스는 환경 변화에 불안정하므로 검체의 안정성을 유지하는 것이 매우 중요합니다.

이를 위해 사용하는 것이 바로 바이러스 수송 배지(VTM, Viral Transport Medium)입니다. VTM은 바이러스 입자를 안정화시키고 생존력을 유지하는 데 도움을 주는 여러 성분들을 포함하고 있습니다. 예를 들어, 세균이나 진균의 오염을 막기 위한 항생제 및 항진균제, 바이러스가 파괴되지 않도록 적절한 pH를 유지해주는 완충액(Buffer), 그리고 단백질 안정제(예: 소 혈청 알부민(BSA) 또는 젤라틴) 등이 들어있습니다.
검체(주로 면봉 검체)를 채취한 후 즉시 VTM 튜브에 넣고, 일반적으로 냉장(2-8°C) 상태로 운송합니다. 만약 운송 시간이 72시간 이상 길어질 것으로 예상되거나 특정 분자 진단 검사를 위해서는 냉동(-70°C 이하 권장) 상태로 운송해야 할 수도 있습니다 [5]. 최근 COVID-19 팬데믹 상황에서 PCR 검사를 위해 코나 목에서 검체를 채취할 때 사용했던 것이 바로 이 VTM입니다.
진균(Fungi) 검체의 경우, 검체 종류가 매우 다양합니다. 피부 각질, 모발, 손발톱, 혈액, 뇌척수액, 조직 등 다양한 부위에서 검체를 얻을 수 있습니다. 운송 방법 역시 검체 종류와 의심되는 진균에 따라 달라집니다. 예를 들어 피부 각질, 모발, 손발톱과 같은 검체는 깨끗하고 건조한 멸균 용기(예: 페트리 접시 또는 종이 봉투)에 담아 상온에서 운송하는 것이 일반적입니다. 습기가 있으면 세균이 과증식하여 진균 배양을 방해할 수 있기 때문입니다. 반면 혈액, 뇌척수액, 조직 등 체액이나 조직 검체는 멸균 용기에 담아 상온 또는 냉장 상태로 신속하게 운송해야 합니다. 진균 배양은 일반적으로 세균 배양보다 시간이 오래 걸리므로(수일에서 수주), 초기 검체의 품질 유지가 더욱 중요합니다.
마지막으로 혈액 배양(Blood culture) 검체는 앞서 잠시 언급했듯이 매우 특별한 취급이 필요합니다. 패혈증(Sepsis)과 같이 혈액 내 세균 감염이 의심될 때 시행하는 이 검사는 환자의 생명과 직결되는 응급 검사인 경우가 많습니다. 혈액 배양 병에는 이미 미생물이 자랄 수 있는 배지가 들어있으므로, 운송의 목적은 균의 생존 유지뿐만 아니라 가능한 한 빨리 증식을 시작하도록 돕는 것입니다.
따라서 절대로 냉장 또는 냉동해서는 안 되며, 반드시 상온(15-25°C)에서 운송해야 합니다. 낮은 온도는 균의 증식을 억제할 뿐만 아니라, 혈액 내 항균 성분의 활성을 유지시켜 오히려 균의 생존에 불리할 수 있습니다 [1]. 채취된 혈액 배양 병은 가능한 한 빨리, 이상적으로는 2시간 이내에, 늦어도 24시간 이내에는 35-37°C로 유지되는 자동 혈액 배양 장비에 넣어야 합니다.
이처럼 특수한 검체들은 각각의 생물학적 특성에 맞는 매우 구체적인 운송 조건을 요구합니다. 만약 이러한 특수 요구사항을 무시하고 일반적인 방법으로 운송한다면, 검사는 실패할 확률이 매우 높습니다. 따라서 검사를 의뢰하는 의료진과 검체를 운송하는 담당자, 그리고 검사를 수행하는 실험실 담당자 모두 각 검체별 정확한 운송 지침을 숙지하고 철저히 준수하는 것이 무엇보다 중요합니다.
지금까지 미생물 검체를 안전하게 실험실까지 옮기는 '운송' 과정에 대해 자세히 알아보았습니다. 적절한 용기를 선택하고, 온도를 철저히 관리하며, 시간을 엄수하는 것, 그리고 특수 검체의 요구사항을 정확히 이해하고 따르는 것이 얼마나 중요한지 충분히 이해하셨으리라 믿습니다.
마치 살아있는 귀한 선물을 목적지까지 안전하게 배송하는 것과 같다고 비유했었지요? 포장이 부실하거나(부적절한 용기), 배송 중 온도가 잘못되거나(온도 관리 실패), 배송이 너무 늦어지면(시간 지연), 선물의 가치가 떨어지거나 완전히 망가질 수 있는 것처럼, 미생물 검체 운송 과정의 작은 실수 하나가 검사 결과 전체를 무의미하게 만들 수 있다는 사실을 반드시 기억해야 합니다.
자, 이렇게 귀하게 운송된 검체는 이제 실험실에 도착했습니다. 그럼 다음 단계는 무엇일까요? 바로 이 검체 안에 숨어있는 미생물을 눈으로 볼 수 있도록 '키우는' 과정, 즉 접종(Inoculation) 단계입니다. 이제부터는 미생물 키우기의 첫 단추인 접종 과정에 대해 자세히 알아보겠습니다.
검체 접종: 미생물 키우기의 첫 단추
성공적으로 운송된 미생물 검체는 이제 실험실에서 다음 단계인 접종 과정을 거치게 됩니다. 검체 접종이란, 검체 속에 들어있는 미생물을 실험실에서 인공적으로 만든 영양분 공급원, 즉 배지(Culture medium)에 옮겨 심어 잘 자랄 수 있도록 하는 과정을 말합니다. 마치 농부가 밭(배지)에 씨앗(미생물)을 심는 것과 같다고 생각할 수 있습니다. 이 과정이 왜 중요할까요?
대부분의 경우, 검체 속에는 미생물이 아주 적은 양으로 존재하거나, 또는 여러 종류의 미생물이 섞여 있습니다. 이런 상태로는 어떤 미생물이 얼마나 있는지, 또 그 미생물의 특징은 무엇인지 정확히 파악하기 어렵습니다. 따라서 배지에 접종하여 미생물의 수를 충분히 늘리고(증균), 여러 종류가 섞여 있다면 각각을 분리하여(순수 분리), 눈으로 관찰 가능한 집락(Colony) 형태로 만들어야 비로소 다음 단계의 검사(현미경 관찰, 생화학적 검사, 항생제 감수성 검사 등)를 진행할 수 있습니다. 즉, 접종은 보이지 않는 미생물의 세계를 우리 눈으로 확인 가능한 수준으로 끌어내는 첫 번째 관문인 셈입니다.
이 접종 과정의 성공 여부는 크게 두 가지 요소에 달려있습니다. 첫째는 검사 목적과 의심되는 미생물에 가장 적합한 배지를 선택하는 것이고, 둘째는 검체를 배지에 정확하고 안전하게 옮겨 심는 기술, 즉 접종 기법입니다. 물론, 이 모든 과정은 외부 잡균에 의한 오염을 막기 위한 철저한 무균 조작(Aseptic technique) 하에 이루어져야 합니다. 자, 그럼 이 중요한 요소들을 하나씩 자세히 들여다볼까요?
배지 선택: 미생물의 입맛 맞추기
미생물 배지(Culture medium, 복수형 Media)는 미생물이 성장하는 데 필요한 영양분을 인공적으로 조합하여 만든 혼합물입니다. 사람에게 탄수화물, 단백질, 지방, 비타민, 무기질 등 다양한 영양소가 필요하듯, 미생물도 종류에 따라 요구하는 영양 성분과 환경 조건이 각기 다릅니다. 따라서 수많은 종류의 배지 중에서 검사 목적(단순히 미생물의 존재 유무 확인, 특정 종류의 미생물만 골라내기, 미생물의 특정 능력 확인 등)과 의심되는 미생물의 특성(영양 요구 조건, 생화학적 특징 등)을 종합적으로 고려하여 최적의 배지를 선택하는 것이 접종 성공의 첫 번째 열쇠라고 할 수 있습니다.
마치 사람마다 좋아하는 음식이 다르듯이, 미생물도 종류에 따라 선호하는 '밥'(배지)이 다르다고 생각하면 이해가 쉬울 것입니다. 어떤 미생물은 아무거나 잘 먹는 '대식가'인 반면, 어떤 미생물은 특정 영양소만 골라 먹는 '미식가'일 수도 있습니다.
미생물 배지는 그 성분과 기능에 따라 매우 다양하게 분류될 수 있습니다. 대표적인 배지 종류와 그 특징을 알아두는 것은 미생물 검사의 기본 중의 기본입니다.
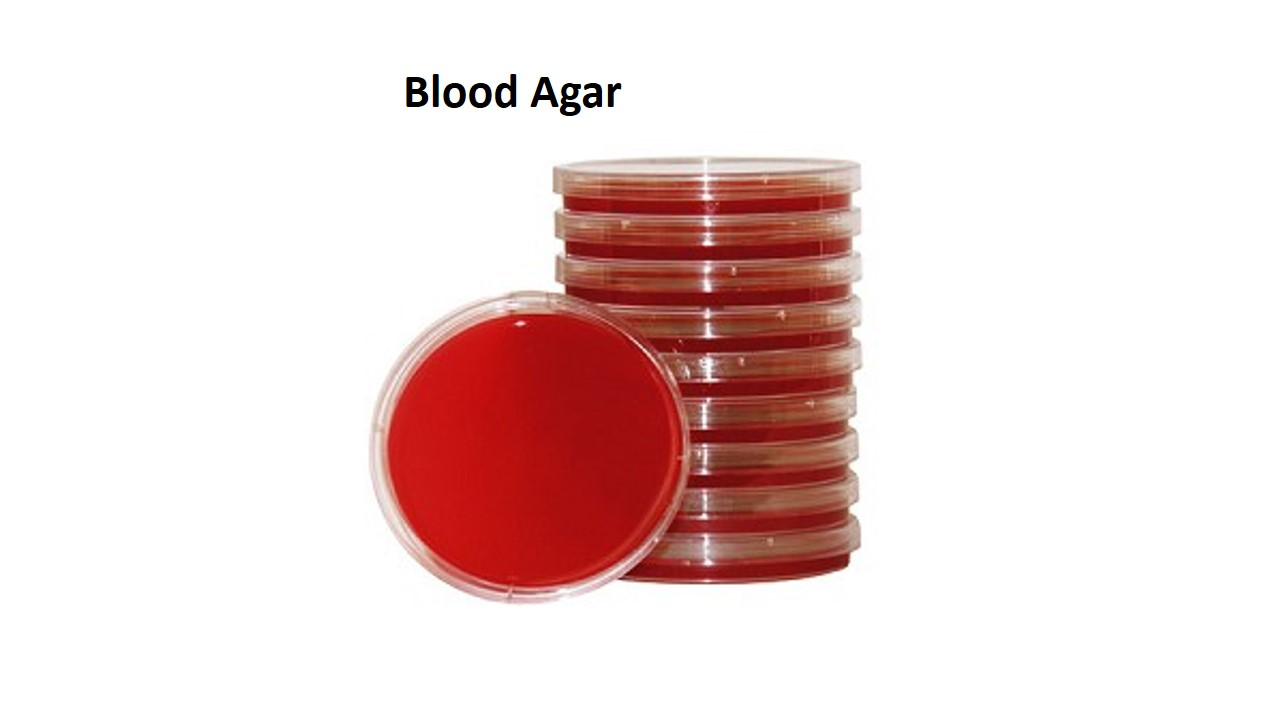
먼저, 가장 기본이 되는 영양 배지(Nutrient media)가 있습니다. 이는 대부분의 미생물이 특별한 요구 조건 없이 성장할 수 있도록 기본적인 영양 성분(탄소원, 질소원, 무기염류, 비타민 등)을 제공하는 배지입니다. 특별히 까다롭지 않은 미생물들의 일반적인 배양이나 보존에 널리 사용됩니다. 대표적인 예로는 펩톤(Peptone), 육즙 추출물(Beef extract), 염화나트륨(NaCl) 등을 주성분으로 하는 영양 한천 배지(Nutrient Agar, NA)나 트립톤(Tryptone), 소이톤(Soytone), 염화나트륨 등이 포함된 트립틱 소이 한천 배지(Tryptic Soy Agar, TSA) 등이 있습니다.
여기서 '한천(Agar)'은 해조류에서 추출한 다당류로, 배지를 액체가 아닌 젤리처럼 단단하게 굳혀주는 역할을 합니다. 고체 배지에서는 미생물이 자라면서 눈에 보이는 덩어리, 즉 집락(Colony)을 형성하기 때문에 미생물을 분리하고 관찰하기에 용이합니다. 물론 한천을 넣지 않은 액체 상태의 영양 액체 배지(Nutrient Broth, NB)나 트립틱 소이 액체 배지(Tryptic Soy Broth, TSB)도 있습니다.
다음으로 증균 배지(Enrichment media)가 있습니다. 이는 검체 속에 소량으로 존재하여 일반 배지에서는 잘 검출되지 않는 특정 미생물의 성장을 선택적으로 촉진시키는 배지입니다. 주로 액체 배지 형태로 사용되며, 특정 미생물에게는 필요한 영양분을 풍부하게 제공하거나, 경쟁 관계에 있는 다른 미생물의 성장을 억제하는 물질을 첨가하기도 합니다. 예를 들어, 식중독의 원인균 중 하나인 살모넬라균(Salmonella)은 대변 검체 내에 다른 장내 세균들에 비해 수가 적을 수 있습니다.

이때 셀레나이트 F 액체 배지(Selenite F Broth)나 테트라티오네이트 액체 배지(Tetrathionate Broth)와 같은 증균 배지에 검체를 먼저 배양하면, 다른 장내 세균의 성장은 억제되면서 살모넬라균의 수가 상대적으로 늘어나 다음 단계의 분리 배양에서 검출될 확률을 높일 수 있습니다. 마치 특정 영양소가 부족한 사람에게 그 영양소를 집중적으로 공급하는 영양제와 같다고 비유할 수 있겠네요.
세 번째는 선택 배지(Selective media)입니다. 이 배지는 특정 종류의 미생물만 선택적으로 잘 자라게 하고, 원하지 않는 다른 미생물의 성장은 억제하는 기능을 가진 배지입니다. 이는 배지 안에 특정 미생물에게는 해롭지만 목표 미생물에게는 영향을 주지 않는 억제 물질(Inhibitory agent)을 첨가함으로써 가능해집니다. 이러한 억제 물질로는 항생제, 염료(Dye), 담즙산염(Bile salt), 고농도의 염분(Salt) 등이 사용될 수 있습니다.

예를 들어, 맥콘키 한천 배지(MacConkey Agar)는 담즙산염과 크리스탈 바이올렛(Crystal violet)이라는 염료를 포함하여 그람 양성균(Gram-positive bacteria)의 성장을 억제하고 그람 음성균(Gram-negative bacteria)만 선택적으로 자라게 합니다. 또 다른 예로, 만니톨 염분 한천 배지(Mannitol Salt Agar, MSA)는 7.5%의 고농도 염화나트륨을 포함하여 대부분의 세균 성장을 억제하지만, 소금기 있는 환경에 잘 견디는 포도알균(Staphylococcus) 속 세균들은 선택적으로 자랄 수 있게 합니다. 마치 특정 음식에 알레르기가 있는 사람은 빼고 원하는 사람들만 초대하는 파티와 같다고 할 수 있습니다.
네 번째는 감별 배지(Differential media)입니다. 이 배지는 배지 위에서 자라는 서로 다른 종류의 미생물들을 특정 생화학적 특성의 차이에 따라 눈으로 쉽게 구별할 수 있도록 고안된 배지입니다. 이는 배지 안에 특정 기질(Substrate)과 그 기질이 분해되거나 대사될 때 발생하는 변화(주로 pH 변화)를 감지하는 지시약(Indicator)을 첨가함으로써 가능합니다. 예를 들어, 앞서 언급한 맥콘키 한천 배지(MacConkey Agar)는 그람 음성균을 선택하는 기능 외에도, 젖당(Lactose)이라는 당 성분과 pH 지시약인 뉴트럴 레드(Neutral red)를 포함하고 있어 감별 기능도 수행합니다.
젖당을 분해하여 산(Acid)을 생성하는 세균(Lactose fermenter, 예: E. coli)은 주변 배지의 pH를 낮추어 지시약 색깔을 변화시키므로 분홍색 또는 붉은색 집락을 형성하는 반면, 젖당을 분해하지 못하는 세균(Lactose non-fermenter, 예: Salmonella, Shigella)은 무색 또는 창백한 색의 집락을 형성합니다. 따라서 집락의 색깔만 보고도 젖당 분해 능력이라는 중요한 생화학적 특성을 알 수 있게 되는 것이지요. 또 다른 예로, 혈액 한천 배지(Blood Agar Plate, BAP)는 영양 배지에 5-10%의 양(Sheep) 혈액을 첨가한 것으로, 세균이 생산하는 용혈소(Hemolysin)라는 독소에 의해 적혈구가 파괴되는 양상(용혈성, Hemolysis)을 관찰할 수 있는 감별 배지입니다.
적혈구를 완전히 파괴하여 집락 주변이 투명하게 보이는 베타 용혈(Beta-hemolysis), 불완전하게 파괴하여 녹색을 띠는 알파 용혈(Alpha-hemolysis), 용혈 현상이 없는 감마 용혈(Gamma-hemolysis) 등으로 구분하여 세균 동정에 중요한 단서를 제공합니다. 마치 리트머스 시험지로 용액의 산성도를 구별하는 것처럼, 배지의 색깔 변화나 특정 반응을 통해 미생물의 숨겨진 특징을 드러내는 역할을 하는 것입니다.
많은 경우, 선택 배지와 감별 배지의 기능이 하나로 합쳐진 선택 감별 배지(Selective and differential media)가 사용됩니다. 맥콘키 한천 배지(MacConkey Agar)가 대표적인 예이며, 이 외에도 그람 음성 장내세균 분리에 사용되는 EMB 한천 배지(Eosin Methylene Blue Agar), 살모넬라균과 이질균(Shigella) 분리에 사용되는 SS 한천 배지(Salmonella-Shigella Agar) 등이 있습니다. 이러한 배지들은 혼합된 검체 속에서 원하는 종류의 미생물만 골라내면서 동시에 그 미생물의 특정 생화학적 특징까지 알려주므로 매우 효율적입니다.
이 외에도 특정 미생물의 특수한 영양 요구 조건을 만족시키거나 특정 생화학 반응을 확인하기 위한 다양한 종류의 특수 배지들이 존재합니다. 예를 들어, 혐기성균 배양을 위한 티오글리콜레이트 배지(Thioglycollate broth)나 혐기성 혈액 한천 배지, 진균 배양에 흔히 사용되는 사부로 포도당 한천 배지(Sabouraud Dextrose Agar, SDA), 결핵균(Mycobacterium tuberculosis) 배양을 위한 로우슈타인-젠센 배지(Löwenstein–Jensen medium) 등이 있습니다.
결국, 어떤 검체에서 어떤 미생물을 찾고 싶은지에 따라 최적의 배지 조합을 선택하는 것이 중요합니다. 예를 들어, 소변 검체에서 요로 감염의 원인균을 찾고자 한다면, 그람 음성균과 그람 양성균 모두를 확인하고 대략적인 균 수를 파악하기 위해 혈액 한천 배지(BAP)와 그람 음성균을 선택하고 젖당 분해능을 감별하는 맥콘키 한천 배지(MacConkey Agar)를 함께 사용하는 것이 일반적입니다. 대변 검체에서 식중독 원인균을 찾고자 한다면, 살모넬라나 이질균과 같은 특정 병원균을 분리하기 위해 맥콘키 한천 배지, SS 한천 배지, 그리고 필요하다면 셀레나이트 F 증균 배지 등을 조합하여 사용할 수 있습니다.
| 배지 종류 | 주요 특징 및 기능 | 대표적인 예시 | 사용 목적 예시 |
|---|---|---|---|
| 영양 배지 | 기본적인 영양분 제공, 비선택적 성장 | Nutrient Agar (NA), Tryptic Soy Agar (TSA), Nutrient Broth (NB), Tryptic Soy Broth (TSB) | 일반적인 세균 배양, 보존, 균 수 측정 전 단계 |
| 증균 배지 | 특정 미생물의 성장을 촉진, 주로 액체 형태 | Selenite F Broth, Tetrathionate Broth, Alkaline Peptone Water (APW) | 검체 내 소수 존재하는 특정 병원균(예: 살모넬라, 비브리오) 증균 |
| 선택 배지 | 특정 미생물만 성장시키고 다른 미생물 성장 억제 | MacConkey Agar (그람 음성균 선택), Mannitol Salt Agar (MSA, 포도알균 선택), CNA Agar (그람 양성균 선택) | 혼합된 검체에서 특정 그룹의 미생물 분리 |
| 감별 배지 | 미생물의 생화학적 특성 차이를 시각적으로 구별 (예: 집락 색깔, 배지 색 변화) | MacConkey Agar (젖당 분해능), Blood Agar Plate (BAP, 용혈성), EMB Agar (젖당/자당 분해능), MSA (만니톨 분해능) | 미생물 동정을 위한 예비 정보 획득 |
| 선택 감별 배지 | 선택 기능과 감별 기능을 동시에 가짐 | MacConkey Agar, EMB Agar, SS Agar, Hektoen Enteric (HE) Agar, XLD Agar | 혼합된 검체에서 특정 미생물을 분리함과 동시에 생화학적 특성 확인 (효율성 높음) |
| 특수 배지 | 특정 미생물의 특수한 영양 요구 조건 충족 또는 특정 목적 수행 | Thioglycollate Broth (혐기성균), Sabouraud Dextrose Agar (SDA, 진균), Löwenstein–Jensen Medium (결핵균) | 혐기성균, 진균, 결핵균 등 특수 미생물 배양 또는 특정 생화학 검사 (예: 운동성 검사 배지) |
이 표는 배지 선택의 기본적인 개념을 이해하기 위한 것이며, 실제 검사실에서는 훨씬 더 다양하고 복잡한 종류의 배지들이 사용되고 있습니다. 중요한 것은 각 배지가 어떤 원리로 작동하며 어떤 정보를 제공해주는지를 정확히 이해하고, 검사 목적에 맞게 현명하게 선택하여 활용하는 능력입니다. 이는 마치 요리사가 다양한 식재료의 특성을 파악하고 레시피에 맞게 적절히 조합하여 최고의 요리를 만들어내는 것과 같다고 할 수 있습니다.
접종 기법: 씨앗을 밭에 심는 기술
자, 이제 검사 목적에 맞는 최적의 배지(밭)를 선택했다면, 다음 단계는 검체(씨앗)를 이 배지에 효과적으로 옮겨 심는 것, 즉 접종(Inoculation)입니다. 이 과정은 단순히 검체를 배지에 묻히는 행위가 아니라, 미생물이 잘 자랄 수 있도록 적절한 양을 균일하게 분산시키고, 특히 여러 미생물이 섞여 있는 검체에서 각각의 미생물을 분리하여 순수한 상태의 단일 집락(Single colony)을 얻기 위한 중요한 기술입니다. 그리고 이 모든 과정은 외부 잡균의 오염을 철저히 방지하기 위한 무균 조작(Aseptic technique) 하에서 수행되어야 함은 두말할 나위가 없습니다.
먼저 무균 조작에 대해 이야기하지 않을 수 없습니다. 우리 주변 환경, 심지어 우리 몸 표면에도 수많은 종류의 미생물이 존재합니다. 만약 검체를 배지에 접종하는 과정에서 이러한 외부 미생물이 함께 딸려 들어간다면, 우리가 원하는 목표 미생물이 아닌 엉뚱한 잡균이 자라거나, 결과 해석을 불가능하게 만들 수 있습니다. 따라서 접종 과정 전체는 외부 미생물의 오염 가능성을 최소화하는 환경과 방법 하에서 이루어져야 합니다. 이것이 바로 무균 조작의 핵심입니다.
무균 조작의 기본 원칙은 다음과 같습니다.
- 작업 환경 관리: 접종 작업은 가급적 공기의 흐름이 적고 먼지가 없는 깨끗한 공간에서 수행해야 합니다. 이상적으로는 생물 안전 작업대(Biological Safety Cabinet, BSC) 또는 클린 벤치(Clean bench)와 같이 여과된 깨끗한 공기가 공급되는 장비 내부에서 작업하는 것이 좋습니다. 작업대 표면은 작업 시작 전과 후에 반드시 소독제(예: 70% 알코올)로 깨끗이 닦아냅니다.
- 멸균된 도구 사용: 접종에 사용되는 모든 도구, 예를 들어 백금이(Inoculating loop) 또는 백금선(Inoculating needle), 피펫 팁(Pipette tip), 유리 삼각봉(Spreader) 등은 반드시 멸균된 상태여야 합니다. 백금이/선은 사용 직전에 알코올 램프나 가스 버너의 불꽃에 빨갛게 달궈질 때까지 가열하여 멸균(화염 멸균, Flame sterilization)하고, 식힌 후 사용합니다. 일회용 멸균 도구를 사용하는 경우도 많습니다.
- 용기 및 배지의 오염 방지: 검체 용기나 배지 접시의 뚜껑을 열 때는 최소한의 시간 동안만, 그리고 완전히 열지 않고 비스듬히 살짝만 열어 공기 중 미생물의 낙하를 최소화합니다. 뚜껑을 작업대 바닥에 내려놓지 않고 손에 들고 있거나, 멸균된 표면 위에 뚜껑 안쪽이 아래로 향하도록 놓습니다. 액체 배지나 시약 병의 입구는 사용 전후로 불꽃 위를 통과시켜(화염 소독) 입구 주변의 오염 가능성을 줄입니다.
- 작업자 위생: 작업자는 손을 깨끗이 씻고 필요한 경우 장갑을 착용합니다. 작업 중에는 말하거나 기침, 재채기를 하지 않도록 주의하며, 불필요한 움직임을 최소화합니다.
이러한 무균 조작 원칙들은 마치 외과 의사가 수술실에서 감염을 막기 위해 철저히 소독하고 관리하는 것과 유사합니다. 작은 부주의 하나가 심각한 오염으로 이어질 수 있으므로, 습관처럼 몸에 익히는 것이 매우 중요합니다.
이제 본격적으로 주요 접종 기법들에 대해 알아보겠습니다. 검체의 종류(액체, 고체, 면봉 등)와 검사 목적(단순 배양, 분리 배양, 균 수 측정 등)에 따라 다양한 접종 방법이 사용됩니다.

가장 기본적이고 널리 사용되는 방법은 획선 평판법(Streak plate method)입니다. 이 방법의 주된 목적은 혼합된 미생물 검체로부터 각각의 미생물이 유래된 순수한 단일 집락(Single colony)을 분리하는 것입니다. 단일 집락이란, 하나의 미생물 세포가 증식하여 형성된 눈에 보이는 덩어리를 의미하며, 이론적으로 동일한 유전적 특성을 가진 미생물들로 구성되어 있습니다. 따라서 단일 집락을 얻는 것은 특정 미생물을 순수하게 분리하여 연구하거나 동정하는 데 필수적인 첫 단계입니다.
획선 평판법은 고체 배지(주로 페트리 접시에 담긴 한천 배지) 표면에 백금이(loop)를 이용하여 검체를 단계적으로 희석시키면서 넓게 펴 바르는 방식으로 수행됩니다. 가장 흔하게 사용되는 4분할 획선법(Quadrant streak)을 예로 들어 설명하면 다음과 같습니다.
- 1구역 접종: 멸균된 백금이에 검체를 소량 묻혀(액체 검체는 한 방울, 고체 검체는 아주 작은 양) 배지 표면의 한쪽 구역(약 1/4 정도)에 지그재그 또는 평행선으로 촘촘하게 획선합니다.
- 백금이 멸균: 사용한 백금이를 불꽃에 빨갛게 달궈 멸균시킨 후, 배지 가장자리 빈 공간에 잠시 대어 식힙니다. (뜨거운 백금이가 미생물을 죽일 수 있으므로 반드시 식혀야 합니다!)
- 2구역 접종: 식힌 백금이를 1구역 끝부분에 2~3번 정도 걸치게 하여 묻어 나온 미생물을 다음 구역(1구역 옆, 약 1/4)으로 끌고 와서 다시 촘촘하게 획선합니다. 이때 1구역과 겹치는 횟수를 최소화하는 것이 중요합니다.
- 백금이 멸균: 다시 백금이를 멸균하고 식힙니다.
- 3구역 접종: 2구역 끝부분에서 미생물을 묻혀 다음 3구역으로 끌고 와 획선합니다.
- 백금이 멸균: 다시 백금이를 멸균하고 식힙니다.
- 4구역 접종: 3구역 끝부분에서 미생물을 묻혀 나머지 4구역 전체에 넓게 획선합니다. 이때는 이전 구역과 겹치지 않도록 주의하며, 가능한 한 선들이 서로 떨어지도록 넓게 펴 발라 단일 집락이 형성될 공간을 확보합니다.
이렇게 단계적으로 희석하며 획선하면, 시작 구역(1구역)에는 미생물이 빽빽하게 자라지만, 뒤로 갈수록(2, 3, 4구역) 미생물의 수가 점차 줄어들어 마지막 구역(주로 3, 4구역)에서는 마침내 각각의 미생물이 서로 충분히 떨어진 상태로 놓이게 됩니다. 이 상태에서 배양하면, 각각의 미생물이 증식하여 서로 분리된 단일 집락들을 형성하게 되는 것입니다. 이 획선 평판법은 미생물학 실험의 가장 기본적이면서도 중요한 기술이므로, 숙련된 기술이 필요합니다. 마치 붓글씨를 쓰듯, 적절한 힘 조절과 각도, 그리고 멸균 과정을 정확하게 수행해야 좋은 결과를 얻을 수 있습니다.
획선 평판법, 너무 복잡하고 어려워 보이는데? 그냥 대충 문지르면 안 되나?
물론 대충 문질러도 미생물이 자라기는 하겠지요. 하지만 획선 평판법의 핵심 목적은 '분리 배양', 즉 단일 집락을 얻는 것에 있습니다. 만약 그냥 문지르기만 한다면 미생물이 너무 빽빽하게 자라서 개별 집락을 구분할 수 없게 되고, 이는 순수 배양 실패로 이어져 정확한 동정이나 감수성 검사를 불가능하게 만듭니다. 따라서 약간의 연습이 필요하더라도, 정확한 획선 평판법을 익히는 것은 미생물 검사의 정확성을 위해 절대적으로 중요합니다.

다음으로 도말 평판법(Spread plate method)이 있습니다. 이 방법은 주로 액체 상태의 검체에 포함된 살아있는 미생물의 수(농도)를 측정(CFU counting, Colony Forming Unit)하고자 할 때 사용됩니다. 먼저, 검체를 적절한 비율로 희석시킨 후, 일정량(보통 0.1mL 정도)을 고체 배지 표면 중앙에 떨어뜨립니다. 그리고 멸균된 유리 삼각봉(Spreader)이나 플라스틱 도구를 이용하여 배지 표면 전체에 골고루 문질러 펴 바릅니다(도말). 배양 후 나타난 집락의 수를 세고 희석 배율을 곱하면, 원래 검체 1mL당 들어있는 미생물의 수(CFU/mL)를 계산할 수 있습니다. 마치 넓은 잔디밭에 씨앗을 골고루 뿌리는 것과 유사한 방식이라고 할 수 있습니다.
주입 평판법(Pour plate method)도 균 수 측정에 사용될 수 있으며, 특히 미호기성(Microaerophilic, 적은 산소 농도를 선호하는) 균이나 혐기성균의 배양에도 이용될 수 있습니다. 이 방법은 희석된 액체 검체 일정량(보통 1mL 정도)을 빈 멸균 페트리 접시에 먼저 넣습니다. 그런 다음, 약 45-50°C 정도로 식힌 액체 상태의 한천 배지를 페트리 접시에 붓고, 검체와 배지가 잘 섞이도록 부드럽게 회전시킨 후 그대로 굳힙니다. 배양하면 미생물 집락이 배지 표면뿐만 아니라 배지 내부에서도 자라게 됩니다.
천자 배양법(Stab culture)은 주로 반고체 상태의 배지(한천 농도가 낮아 약간 묽은 배지)를 이용하여 미생물의 운동성(Motility)을 확인하거나 특정 생화학 반응을 관찰할 때 사용됩니다. 멸균된 백금선(needle) 끝에 미생물을 소량 묻혀 배지 중앙을 따라 수직으로 깊숙이 찔러 넣었다가 그대로 빼냅니다. 배양 후, 운동성이 있는 미생물은 찔러 넣은 선(천자선)을 따라 주변으로 퍼져나가 배지가 혼탁해지는 양상을 보이는 반면, 운동성이 없는 미생물은 천자선 주변에서만 자랍니다.
마지막으로 액체 배지 접종은 가장 간단한 방법 중 하나로, 증균 배양이나 대량 배양 등을 목적으로 할 때 사용됩니다. 멸균된 백금이(loop)나 피펫을 이용하여 검체 또는 이미 배양된 미생물 집락 일부를 액체 배지가 담긴 시험관이나 플라스크에 직접 넣고 흔들어 섞어주면 됩니다.
| 접종 기법 | 주요 목적 | 사용 도구 | 방법 요약 | 결과 형태 |
|---|---|---|---|---|
| 획선 평판법 | 단일 집락 분리 (순수 배양) | 백금이 (Loop) | 고체 배지 표면에 단계적 희석하며 획선 (예: 4분할법). 각 단계 후 백금이 멸균. | 마지막 구역에 분리된 단일 집락 형성 |
| 도말 평판법 | 균 수 측정 (CFU counting), 균일한 배양 | 피펫, 유리 삼각봉 (Spreader) | 고체 배지 표면에 희석된 액체 검체 일정량 분주 후, 삼각봉으로 전체 표면에 골고루 펴 바름. | 배지 표면에 균일하게 분포된 집락들 |
| 주입 평판법 | 균 수 측정, 미호기성/혐기성균 배양 | 피펫, 액체 한천 배지 | 빈 페트리 접시에 액체 검체 분주 후, 식힌 액체 배지를 부어 섞고 굳힘. | 배지 표면 및 내부에 집락 형성 |
| 천자 배양법 | 운동성 확인, 특정 생화학 반응 관찰 | 백금선 (Needle) | 반고체 배지 중앙에 수직으로 찔러 넣었다 뺌. | 천자선 주변 성장 양상 (퍼짐 여부) 관찰 |
| 액체 배지 접종 | 증균 배양, 대량 배양, 특정 생화학 검사 | 백금이 (Loop), 피펫 | 액체 배지에 검체 또는 집락 직접 접종 후 혼합. | 배지 혼탁도 증가 (미생물 증식) |
어떤 접종 기법을 사용할지는 검체의 종류, 상태, 그리고 궁극적으로 얻고자 하는 정보가 무엇인지에 따라 결정됩니다. 예를 들어, 혼합된 세균 검체에서 특정 병원균을 분리하고 동정하는 것이 목적이라면 획선 평판법이 필수적일 것이고, 식품이나 물 속의 총 세균 수를 알고 싶다면 도말 평판법이나 주입 평판법이 적합할 것입니다. 따라서 각 접종 기법의 원리와 목적을 정확히 이해하고 상황에 맞게 적용하는 능력이 중요합니다.
접종 후 배양: 미생물이 자라는 환경 만들기
자, 이제 적절한 배지에 정확한 방법으로 검체를 접종했다면, 마지막으로 미생물이 실제로 자랄 수 있는 최적의 환경을 제공해주어야 합니다. 이것이 바로 배양(Incubation) 과정입니다. 접종된 배지는 미생물의 종류에 따라 가장 잘 성장할 수 있는 특정 온도, 습도, 그리고 산소 조건(또는 무산소 조건)을 갖춘 배양기(Incubator) 안에서 일정 시간 동안 보관됩니다. 마치 씨앗을 심은 밭에 적절한 햇빛과 물, 그리고 공기를 공급해주어야 싹이 트고 자라나는 것과 같습니다.
배양에서 가장 중요한 조건은 역시 온도입니다. 대부분의 인체 병원성 세균은 사람의 체온과 비슷한 35-37°C에서 가장 잘 자랍니다. 따라서 일반적인 세균 배양은 이 온도 범위로 설정된 배양기를 사용합니다. 하지만 예외도 있습니다. 예를 들어, 일부 식중독균인 Campylobacter jejuni는 약간 더 높은 온도인 42°C에서 더 잘 자라며, 피부 감염을 일으키는 일부 진균(곰팡이)은 그보다 낮은 25-30°C에서 배양하는 것이 일반적입니다. 따라서 배양 온도 역시 검사 대상 미생물의 특성을 고려하여 설정해야 합니다.
산소 조건 역시 매우 중요합니다. 미생물은 산소 요구성에 따라 크게 다음과 같이 나눌 수 있습니다.
- 호기성균(Aerobes): 성장에 산소가 반드시 필요한 균 (예: 결핵균, 녹농균).
- 혐기성균(Anaerobes): 산소가 없는 환경에서만 자라거나, 산소가 있으면 오히려 죽는 균 (예: 파상풍균, 클로스트리듐).
- 통성 혐기성균(Facultative anaerobes): 산소가 있거나 없거나 모두 자랄 수 있지만, 산소가 있을 때 더 잘 자라는 균 (예: 대장균, 포도알균 등 대부분의 병원성 세균).
- 미호기성균(Microaerophiles): 대기 중 산소 농도(약 21%)보다 훨씬 낮은 농도의 산소(보통 5-10%)를 선호하는 균 (예: Campylobacter, Helicobacter).
- 내기성 혐기성균(Aerotolerant anaerobes): 산소가 있어도 죽지는 않지만, 산소를 이용하지 못하고 혐기성 대사만 하는 균.
따라서 어떤 종류의 미생물을 배양하느냐에 따라 배양 환경의 산소 조건을 조절해주어야 합니다. 일반적인 호기성균이나 통성 혐기성균은 일반 배양기(대기 중 산소 농도)에서 배양하면 됩니다. 하지만 이산화탄소(CO2) 농도가 약간 높을 때(5-10%) 더 잘 자라는 미생물(Capnophiles, 예: Neisseria, Haemophilus)을 위해서는 CO2 배양기를 사용합니다.

혐기성균을 배양하기 위해서는 산소를 완전히 제거한 환경을 만들어주어야 하는데, 이를 위해 혐기성 챔버(Anaerobic chamber)라는 특수 장비를 사용하거나, 밀폐 용기 안에 가스 발생 키트(Gas-generating kit)와 산소 지시약을 함께 넣어 산소를 제거하고 혐기 상태를 유지하는 혐기성 자(Anaerobic jar)를 이용합니다. 미호기성균 역시 유사한 방식으로 낮은 산소와 높은 이산화탄소 농도를 유지하는 환경(예: 가스팩 이용)을 만들어 배양합니다.
습도 역시 배양에 영향을 미칩니다. 배양 시간이 길어지면 배지가 건조되어 미생물 성장에 지장을 줄 수 있으므로, 배양기 내부에 물 접시 등을 놓아 적절한 습도(보통 70% 이상)를 유지해주는 것이 좋습니다.
배양 시간은 미생물의 종류와 성장 속도에 따라 크게 달라집니다. 대부분의 일반 세균은 18-24시간 배양하면 눈에 보이는 집락을 형성합니다. 하지만 일부 느리게 자라는 세균이나 특정 배지에서는 48-72시간 또는 그 이상 배양이 필요할 수도 있습니다. 결핵균과 같은 일부 미생물은 성장 속도가 매우 느려 수 주(2-8주) 동안 배양해야 하며, 진균 역시 수 일에서 수 주의 배양 기간이 필요할 수 있습니다. 따라서 검사 목적과 의심되는 미생물에 따라 적절한 배양 시간을 설정하고, 중간중간 배양 상태를 확인하는 것이 중요합니다.
이렇게 정해진 조건 하에서 충분한 시간 동안 배양을 마치고 나면, 드디어 우리는 배지 위에 자라난 미생물 집락(Colony)을 관찰할 수 있게 됩니다. 이때 단순히 미생물이 자랐는지 여부만 확인하는 것이 아니라, 집락의 형태학적 특징을 자세히 관찰하는 것이 중요합니다. 예를 들어, 집락의 크기(Size), 모양(Form: 원형, 불규칙형 등), 가장자리(Margin: 매끈함, 톱니 모양 등), 표면 질감(Texture: 매끄러움, 거침, 점액성 등), 색깔(Color), 투명도(Opacity), 그리고 혈액 한천 배지에서의 용혈성(Hemolysis) 등은 미생물의 종류를 추정하는 데 매우 중요한 단서가 됩니다. 또한, 감별 배지에서는 배지 색깔의 변화 등을 통해 해당 미생물의 특정 생화학적 특성을 파악할 수 있습니다.
이렇게 배양 결과를 면밀히 판독하고 나면, 다음 단계로 현미경 검사(그람 염색 등), 생화학적 동정 검사, 항생제 감수성 검사 등을 진행하여 최종적으로 어떤 미생물이 감염의 원인인지, 그리고 어떤 치료제가 효과적일지를 결정하게 됩니다.
지금까지 미생물 검체를 배지에 옮겨 심고 키우는 '접종'과 '배양' 과정에 대해 살펴보았습니다. 적절한 배지를 선택하는 것부터 시작하여, 정확하고 오염 없는 접종 기술을 사용하고, 마지막으로 미생물이 자라기에 최적인 환경 조건을 제공하는 것까지, 이 모든 과정은 눈에 보이지 않는 작은 생명체를 성공적으로 키워내기 위한 세심한 노력과 과학적 지식이 요구되는 과정입니다. 마치 정성껏 씨앗을 골라(배지 선택) 기름진 밭에 심고(접종), 알맞은 온도와 습도, 햇빛을 제공하여(배양) 마침내 튼튼한 작물을 수확하는 농부의 마음과 같다고 할 수 있을 것입니다. 이 과정에서의 작은 실수나 부주의는 결국 잘못된 수확물(부정확한 검사 결과)로 이어질 수 있음을 항상 명심해야 합니다.
품질 관리 및 안전: 오류 없는 결과를 위한 노력
지금까지 미생물 검체의 운송과 접종이라는 두 가지 핵심 과정을 아주 상세하게 살펴보았습니다. 하지만 이 모든 과정이 단지 기술적인 절차의 나열에 그쳐서는 안 됩니다. 미생물 검사의 모든 단계, 특히 검체 운송 및 접종 과정에서는 최종 결과의 신뢰성을 확보하고 동시에 검사를 수행하는 사람과 주변 환경의 안전을 지키기 위한 철저한 품질 관리(Quality Control, QC) 및 생물 안전(Biosafety) 규정 준수가 절대적으로 중요합니다. 아무리 최첨단 장비와 기술을 사용한다 하더라도, 기본적인 품질 관리와 안전 수칙이 지켜지지 않는다면 그 결과는 신뢰할 수 없으며, 심각한 위험을 초래할 수도 있습니다. 이는 마치 자동차 경주에서 아무리 성능 좋은 차와 뛰어난 드라이버가 있어도, 기본적인 차량 점검과 안전 규정을 무시한다면 결코 좋은 성적을 거둘 수 없고 사고의 위험만 높아지는 것과 같습니다.
운송 및 접종 과정의 품질 관리
미생물 검사 결과의 정확성과 신뢰성을 보장하기 위해서는 검체 채취부터 시작하여 운송, 접종, 배양, 동정, 결과 보고에 이르는 전 과정에 걸쳐 표준화된 작업 절차(Standard Operating Procedure, SOP)를 확립하고, 이를 일관성 있게 준수하며, 주기적인 점검과 기록을 통해 발생 가능한 오류를 사전에 감지하고 예방하는 체계적인 품질 관리 시스템이 반드시 필요합니다. 특히 운송 및 접종 단계에서의 품질 관리는 검사의 가장 초기 단계에서부터 결과의 질을 좌우하는 핵심적인 요소입니다.
구체적으로 어떤 품질 관리 활동들이 이루어져야 할까요? 몇 가지 중요한 예를 들어보겠습니다.
- 운송 용기 및 배지의 관리: 사용하는 모든 운송 용기, 수송 배지, 그리고 접종에 사용될 배지는 반드시 유효 기간 내에 있는지 확인해야 합니다. 유효 기간이 지난 제품은 성능이 저하되었을 수 있습니다. 또한, 이들은 제조사의 권장 사항에 따라 적절한 온도와 조건에서 보관되어야 합니다. 예를 들어, 대부분의 한천 배지 플레이트는 냉장 보관해야 하며, 사용 전에는 오염이나 건조, 변색 등이 없는지 육안으로 확인해야 합니다.
- 운송 조건 모니터링: 검체 운송 시에는 규정된 온도와 시간이 철저히 준수되었는지 확인하고 기록해야 합니다. 특히 장거리 운송이나 외부 기관으로 검체를 보낼 경우에는 운송 상자 내부에 온도 기록 장치(Data logger)를 함께 넣어 운송 중 온도 변화를 모니터링하는 것이 중요합니다. 실험실에 검체가 도착하면 접수 담당자는 검체의 종류, 채취 시간, 도착 시간, 보관 상태(온도 등)를 정확히 확인하고 기록해야 합니다. 만약 규정된 조건을 벗어난 검체가 접수되었다면, 검사의 신뢰성에 문제가 있을 수 있음을 인지하고 필요하다면 재채취를 요청해야 합니다.
- 접종 환경 및 도구 관리: 접종 작업을 수행하는 생물 안전 작업대(BSC)나 클린 벤치는 정기적으로 성능 검사(필터 교체, 풍속 측정 등)를 받고 유지 관리되어야 합니다. 접종에 사용하는 백금이, 백금선, 피펫 등은 항상 청결하게 관리하고 사용 전후 멸균을 철저히 해야 합니다. 알코올 램프나 가스 버너 역시 정상적으로 작동하는지 확인해야 합니다.
- 배지 성능 검사 (QC): 실험실에서 직접 만들거나 구매하여 사용하는 모든 배지는 실제로 미생물을 잘 자라게 하는지, 그리고 선택/감별 기능이 제대로 작동하는지 주기적으로 성능 검사를 받아야 합니다. 이를 위해 표준 균주(Standard strain, QC strain), 즉 이미 특성이 잘 알려진 미생물을 이용하여 배지에 접종하고 예상되는 결과(성장 유무, 집락 형태, 색깔 변화 등)가 나타나는지 확인합니다. 예를 들어, 맥콘키 한천 배지의 성능을 검사하기 위해서는 젖당 분해 양성 대조군(E. coli 등), 젖당 분해 음성 대조군(Salmonella 등), 그리고 성장 억제 대조군(그람 양성균, 예: Staphylococcus aureus)을 각각 접종하여 예상대로 자라고 색깔이 변하는지, 또는 자라지 않는지를 확인해야 합니다. 이러한 QC 결과는 반드시 기록하고 관리해야 합니다.
- 검사자 교육 및 숙련도 평가: 검체 운송 및 접종을 담당하는 모든 직원은 관련 SOP에 대한 충분한 교육을 받고, 정기적으로 기술적인 숙련도를 평가받아야 합니다. 특히 획선 평판법과 같은 수작업 기술은 개인 간의 차이가 발생할 수 있으므로, 일관성 있는 결과를 얻기 위한 지속적인 교육과 훈련이 중요합니다.
이 모든 품질 관리 활동에서 가장 중요한 것 중 하나는 바로 '기록'입니다. 모든 절차, 점검 결과, 문제 발생 및 조치 사항 등을 상세하게 문서화하고 보관해야 합니다. 이는 단순히 규정을 지키기 위함이 아니라, 만약 예상치 못한 결과가 발생했을 때 그 원인을 추적하고 분석하여 시스템을 개선하는 데 결정적인 단서를 제공하기 때문입니다. 예를 들어, 특정 기간 동안 특정 검사의 위양성률이 증가했다면, 해당 기간의 배지 QC 기록, 운송 온도 기록, 작업자 교육 기록 등을 검토하여 문제의 원인을 찾아내고 재발 방지 대책을 수립할 수 있는 것입니다.
또한, CLSI와 같은 국제 표준 기관에서 제시하는 가이드라인을 준수하는 것은 품질 관리의 중요한 부분입니다. 이러한 가이드라인은 전 세계 수많은 전문가들의 경험과 연구 결과를 바탕으로 만들어진 최선의 실행 지침(Best practice)이므로, 이를 따르는 것은 검사실의 품질 수준을 높이고 국제적인 기준에 부합하는 결과를 생산하는 데 큰 도움이 됩니다.
결론적으로, 미생물 검사의 품질 관리는 어느 한 부분에 국한된 것이 아니라, 검체 채취부터 결과 보고까지 이어지는 전체 과정에 대한 지속적이고 체계적인 관리 시스템이며, 이는 정확하고 신뢰할 수 있는 검사 결과를 제공하기 위한 필수적인 투자라고 할 수 있습니다.
생물 안전 : 나와 환경을 지키는 길
미생물 검사실은 잠재적으로 위험한 병원성 미생물을 다루는 곳입니다. 따라서 검사 결과의 정확성만큼이나 중요한 것이 바로 검사자 자신과 동료, 그리고 실험실 외부 환경의 안전을 확보하는 것입니다. 이를 위한 모든 조치와 규정을 통틀어 생물 안전(Biosafety)이라고 합니다. 미생물 검체는 어떤 종류이든 감염 가능성이 있다고 간주하고(Universal precaution), 취급 시에는 반드시 정해진 안전 수칙을 철저히 준수해야 합니다. 이는 검사자 개인의 건강을 지키는 것은 물론, 실험실 내 감염(Laboratory-acquired infection, LAI)이나 병원체의 외부 유출로 인한 공중 보건 위협을 방지하기 위해 절대적으로 필요합니다.
생물 안전의 핵심 요소들은 다음과 같습니다.
- 개인 보호 장비 (Personal Protective Equipment, PPE) 착용: 미생물 검체나 배양된 미생물을 취급할 때는 반드시 적절한 PPE를 착용해야 합니다. 가장 기본적인 PPE로는 실험복(Lab coat), 장갑(Gloves), 그리고 필요한 경우 보안경(Safety glasses)이나 안면 보호대(Face shield), 마스크(Mask) 등이 있습니다. 실험복은 실험 구역 내에서만 착용하고, 실험실을 나갈 때는 반드시 벗어야 합니다. 장갑은 검체나 미생물에 직접 접촉하는 작업을 할 때 착용하며, 오염 시 즉시 교체하고 작업이 끝나면 벗은 후 손을 깨끗이 씻어야 합니다. 에어로졸(Aerosol, 공기 중에 미세한 입자가 떠다니는 것) 발생 가능성이 있는 작업(예: 원심분리, 강하게 흔들기 등)을 할 때는 마스크와 보안경 착용이 권장됩니다. PPE는 올바르게 착용하는 것만큼이나 안전하게 벗고 폐기하는 것도 중요합니다.
- 생물 안전 등급 (Biosafety Level, BSL) 준수: 미생물은 감염 시 질병의 심각도, 전파 경로, 예방 및 치료 가능성 등에 따라 위험군(Risk Group) 1부터 4까지로 분류됩니다. 이에 따라 해당 미생물을 안전하게 취급하기 위해 요구되는 시설, 장비, 안전 수칙의 수준을 규정한 것이 생물 안전 등급(BSL) 1부터 4입니다.
- BSL-1: 건강한 성인에게 질병을 일으키지 않는 것으로 알려진 미생물 (예: 비병원성 E. coli). 기본적인 실험실 안전 수칙 준수가 요구됩니다.
- BSL-2: 피부 상처, 점막 노출, 섭취 등을 통해 감염될 수 있으나 심각한 질병을 유발할 가능성은 낮고 예방/치료법이 있는 미생물 (예: Staphylococcus aureus, Salmonella spp., HIV, HBV). 대부분의 임상 검사실에서 다루는 병원체들이 여기에 해당하며, 제한 구역 표시, 생물 안전 작업대(BSC Class II 권장), 고압 증기 멸균기 등이 요구됩니다. PPE 착용이 필수적입니다.
- BSL-3: 에어로졸 흡입을 통해 감염될 수 있고, 감염 시 심각하거나 치명적인 질병을 유발할 수 있으나 예방/치료법이 있는 미생물 (예: 결핵균 Mycobacterium tuberculosis, 탄저균 Bacillus anthracis, SARS-CoV-2). 엄격한 출입 통제, 음압 시설, 전용 환기 시스템, BSC Class II 또는 III 사용 등이 요구되며, 모든 작업은 BSC 내에서 수행해야 합니다. 호흡 보호구 착용이 필수적일 수 있습니다.
- BSL-4: 에어로졸 전파 가능성이 높고, 감염 시 매우 치명적인 질병을 유발하며 예방/치료법이 없는 고위험 미생물 (예: 에볼라 바이러스, 마버그 바이러스). 최고 수준의 밀폐 시설과 특수 장비(양압복, BSC Class III 등)가 요구되며, 극도로 엄격한 안전 관리 절차가 적용됩니다.
- 임상 검사실에서는 대부분 BSL-2 수준의 안전 수칙을 준수*해야 하며, 결핵균과 같이 BSL-3에 해당하는 미생물을 취급할 때는 해당 규정에 맞는 시설과 절차를 따라야 합니다.
- 생물 안전 작업대 (Biological Safety Cabinet, BSC)의 올바른 사용: BSC는 에어로졸 발생 가능성이 있는 작업을 안전하게 수행하기 위한 필수 장비입니다. 내부 공기를 HEPA 필터(High-Efficiency Particulate Air filter)로 여과하여 작업자와 환경을 보호합니다. BSC 사용 전후에는 내부 소독을 철저히 하고, 작업 중에는 공기 흐름을 방해하지 않도록 내부를 깔끔하게 정리하며, 급격한 움직임을 삼가야 합니다. BSC는 정기적인 점검과 인증(Certification)을 통해 성능을 유지해야 합니다.
- 사고 발생 시 비상 대응 계획: 아무리 주의를 기울여도 사고는 발생할 수 있습니다. 검체나 배양액이 쏟아지거나(Spill), 주사침에 찔리거나(Needlestick injury), 장비가 고장 나는 등의 비상 상황에 대비한 명확한 대응 계획과 절차를 수립하고 모든 직원이 숙지하고 있어야 합니다. 여기에는 즉각적인 응급 처치 방법, 오염 확산 방지 조치, 사고 보고 절차, 필요한 경우 노출 후 예방 조치(Post-exposure prophylaxis, PEP) 등이 포함되어야 합니다.
- 감염성 폐기물의 안전한 처리: 미생물 검사 과정에서 발생하는 모든 폐기물, 예를 들어 사용한 배지, 검체 용기, 장갑, 피펫 팁 등은 잠재적인 감염성 폐기물로 간주해야 합니다. 이러한 폐기물은 반드시 일반 폐기물과 분리하여 지정된 용기(보통 붉은색 또는 노란색의 생물학적 위험 표시가 있는 용기)에 수거해야 합니다. 수거된 감염성 폐기물은 실험실 외부로 반출되기 전에 반드시 고압 증기 멸균(Autoclaving) 등의 방법으로 멸균 처리하여 감염 위험을 제거해야 하며, 이후 관련 법규에 따라 안전하게 최종 처리되어야 합니다.
| 생물 안전 등급 (BSL) | 위험군 (Risk Group) | 대상 미생물 예시 | 주요 안전 수칙 및 시설 요구사항 |
|---|---|---|---|
| BSL-1 | 1 | 비병원성 E. coli, Bacillus subtilis | 표준 미생물학적 수칙 (손 씻기, 실험복 착용 등). 개방된 실험대에서 작업 가능. |
| BSL-2 | 2 | Staphylococcus aureus, Salmonella spp., HIV, HBV, Influenza virus | BSL-1 수칙 + 제한 구역, 생물학적 위험 표시, BSC Class II (에어로졸 발생 시), 고압 증기 멸균기, PPE (장갑, 실험복, 필요시 보안경/마스크) 필수. 대부분의 임상 검사실 해당. |
| BSL-3 | 3 | Mycobacterium tuberculosis, Bacillus anthracis, SARS-CoV-2, Yellow fever virus | BSL-2 수칙 + 엄격한 출입 통제, 이중 문, 음압 환기 시스템 (실험실 공기 외부 재순환 금지), 모든 작업은 BSC 내에서 수행, 호흡 보호구 (N95 등) 필요할 수 있음. |
| BSL-4 | 4 | Ebola virus, Marburg virus, Lassa virus | BSL-3 수칙 + 별도 건물 또는 완전 격리 구역, 전용 공기 공급/배출 시스템, 샤워 시설 필수, BSC Class III 또는 전신 양압복 착용 필수. 최고 수준의 보안 및 안전 관리. |
생물 안전은 단순히 규칙을 지키는 것을 넘어, 자신과 동료, 그리고 사회 전체의 건강을 보호하기 위한 책임감 있는 태도와 실천입니다. 미생물 검사실에서 일하는 모든 사람은 항상 잠재적인 위험성을 인지하고, 규정된 안전 수칙을 습관처럼 준수해야 합니다. "나 하나쯤이야" 하는 안일한 생각이 큰 사고로 이어질 수 있다는 것을 명심해야 합니다.
자, 이제 미생물 검체의 운송과 접종, 그리고 이 과정에서의 품질 관리와 생물 안전에 대한 긴 여정을 마무리할 시간입니다. 마지막으로 오늘 다룬 내용들을 다시 한번 정리하며 핵심을 되짚어 보겠습니다.
보이지 않는 세계를 다루는 섬세함과 책임감
이번 시간에는 우리 눈에 보이지 않는 작은 생명체, 미생물을 정확하게 찾아내기 위한 여정의 첫 두 단계인 미생물 검체의 운송과 접종에 대해 아주 깊이 있게 살펴보았습니다. 얼핏 단순해 보일 수 있는 이 과정들이 실제로는 검사 결과의 정확성과 신뢰성을 좌우하는 얼마나 중요하고 섬세한 작업인지, 그리고 왜 그렇게 많은 주의와 노력이 필요한지에 대해 충분히 공감하셨기를 바랍니다.
우리는 먼저 미생물 검체를 왜 제대로 다루어야 하는지에 대한 근본적인 이유부터 시작했습니다. 검체 속 미생물은 살아있는 생명체이기에, 생존력 유지, 과증식 방지, 그리고 외부 오염 차단이라는 세 가지 목표를 달성하지 못하면 위음성이나 위양성 같은 치명적인 오류를 초래할 수 있으며, 이는 곧 환자의 진단과 치료에 심각한 영향을 미칠 수 있다는 점을 강조했습니다.
다음으로, 검체 운송 과정에서는 시간과 온도와의 싸움이 얼마나 중요한지를 배웠습니다. 검체 종류와 검사 목적에 맞는 최적의 운송 용기를 선택하는 것이 첫걸음이며, 특히 수송 배지와 같은 특수 용기의 역할이 중요함을 확인했습니다. 또한, 상온, 냉장, 냉동 중 어떤 온도를 선택하고 유지하느냐가 미생물의 생사를 가를 수 있으며, 검체 채취 후 실험실 도착까지의 시간을 최대한 단축하는 것이 검체의 신선도, 즉 품질을 유지하는 데 결정적임을 알아보았습니다. 특히 혐기성균, 바이러스, 혈액 배양 등 특수 검체는 더욱 까다로운 운송 조건을 요구한다는 점도 잊지 말아야 합니다.
이어서, 실험실에 도착한 검체를 배지에 옮겨 심는 접종 과정에 대해 탐구했습니다. 검사 목적과 미생물의 특성에 맞는 최적의 배지를 선택하는 것이 마치 미생물의 입맛에 맞는 밥상을 차려주는 것과 같다는 것을 배웠습니다. 영양 배지, 증균 배지, 선택 배지, 감별 배지 등 다양한 배지의 종류와 기능을 이해하는 것이 중요하며, 특히 선택 감별 배지의 효율성에 주목했습니다. 또한, 획선 평판법을 이용한 단일 집락 분리의 중요성과 원리를 자세히 살펴보았고, 이 외에도 도말 평판법, 주입 평판법, 천자 배양법 등 다양한 접종 기법의 목적과 방법을 알아보았습니다. 이 모든 접종 과정은 철저한 무균 조작 하에 이루어져야 오염을 방지할 수 있다는 점을 다시 한번 강조했습니다.
접종 후에는 미생물이 잘 자랄 수 있도록 최적의 배양 환경(온도, 산소, 습도)을 제공하고, 적절한 시간 동안 배양한 뒤 나타난 집락의 형태를 관찰하여 다음 단계의 검사를 준비하게 됩니다.
마지막으로, 이 모든 기술적인 과정이 제대로 이루어지도록 뒷받침하는 품질 관리(QC)와 생물 안전(Biosafety)의 중요성을 강조했습니다. 표준 작업 절차(SOP) 수립, 주기적인 점검과 기록, 표준 가이드라인 준수 등 체계적인 품질 관리는 결과의 신뢰성을 보장하는 핵심이며, 개인 보호 장비(PPE) 착용, 생물 안전 등급(BSL) 준수, 감염성 폐기물의 안전한 처리 등 생물 안전 수칙 준수는 검사자와 환경을 보호하기 위한 필수적인 책임임을 확인했습니다.
결론적으로, 미생물 검체의 운송과 접종은 단순한 기술적 절차가 아니라, 보이지 않는 세계의 생명체를 다루는 극도의 섬세함과 정확성, 그리고 과학적 원리에 대한 깊은 이해가 요구되는 책임감 있는 과정입니다. 이 초기 단계에서의 작은 실수나 부주의가 최종 검사 결과에 미치는 영향은 실로 막대하며, 이는 곧 환자의 건강과 생명에 직결될 수 있습니다. 따라서 이 분야에 종사하는 모든 전문가들은 항상 최고의 표준을 유지하기 위해 노력해야 하며, 끊임없이 지식을 업데이트하고 기술을 연마해야 할 것입니다.
오늘 이 글을 통해 미생물 검사의 숨겨진 과정에 대한 여러분의 이해가 한층 깊어졌기를 바랍니다. 눈에 보이지 않기에 더욱 신비롭고, 때로는 위험하지만, 우리 삶과 건강에 지대한 영향을 미치는 미생물의 세계를 탐구하는 여정에 앞으로도 많은 관심을 가져주시길 바라며 글을 마칩니다.
2025.04.17 - [임상미생물] - 세균배양검사를 위한 배지의 종류
세균배양검사를 위한 배지의 종류
여러분, 혹시 병원에서 피검사나 소변검사를 받아보신 경험이 있으신가요? 때로는 의사 선생님께서 "세균 배양 검사를 해봅시다"라고 말씀하시는 경우도 있는데요, 도대체 눈에 보이지도 않는
labdoctor.tistory.com
2025.04.15 - [AI 정보의학 IT] - 구글에서 공개한 프롬프트 엔지니어링 가이드 문서 완벽 정리!
구글에서 공개한 프롬프트 엔지니어링 가이드 문서 완벽 정리!
며칠 전 구글에서 제시한 프롬프트 엔지니어링에 관한 엄청난 소개 자료가 공개되어 많은 사람들에게 인기를 끌었습니다프롬프트 엔지니어링의 알파와 오메가바로 이 자료 인데요, 프롬프트
labdoctor.tistory.com
2025.04.15 - [분자진단] - Microarray 검사의 원리와 방법, 적용 분야
Microarray 검사의 원리와 방법, 적용 분야
여러분은 혹시 수천, 수만 가지 종류의 상품이 빼곡히 들어찬 거대한 창고에서 특정 상품 몇 가지를 찾아내야 하는 상황을 상상해 보신 적이 있나요? 혹은 복잡한 질병의 원인을 밝히기 위해 환
labdoctor.tistory.com
2025.04.13 - [분자진단] - NGS (Next Generation Sequencing)의 개념, 원리, 방법, 적용 분야
NGS (Next Generation Sequencing)의 개념, 원리, 방법, 적용 분야
이번 시간에는 현대 생명과학과 의학 연구의 패러다임을 바꾼 혁신적인 기술, 차세대 염기서열 분석(Next Generation Sequencing, NGS)에 대해 심도 있게 알아보겠습니다. 혹시 몇 년 전, 유명 할리우드
labdoctor.tistory.com
참고문헌
- Baron, E. J., Miller, J. M., Weinstein, M. P., Richter, S. S., Gilligan, P. H., Thomson Jr, R. B., ... & Pritt, B. S. (2013). A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2013 recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM). Clinical Infectious Diseases, 57(4), e22-e121. (특히 혈액 배양 관련 내용 참조)
- CLSI. Urinalysis; Approved Guideline—Third Edition. CLSI document GP16-A3. Wayne, PA: Clinical and Laboratory Standards Institute; 2009. (소변 검체 보관 시간 관련 가이드라인)
- CLSI. Quality Control of Microbiological Transport Systems; Approved Standard. CLSI document M40-A2. Wayne, PA: Clinical and Laboratory Standards Institute; 2014. (미생물 수송 시스템 품질 관리 표준)
- Summanen, P. H., Baron, E. J., Citron, D. M., Strong, C. A., Wexler, H. M., & Finegold, S. M. (1993). Wadsworth anaerobic bacteriology manual. Star Publishing Company. (혐기성 세균 검체 취급 관련 내용)
- CDC. Guidelines for Clinical Specimen Collection, Transport, and Handling for Viral Respiratory Infections. https://www.cdc.gov/coronavirus/2019-ncov/lab/guidelines-clinical-specimens.html (바이러스 검체 운송 관련 가이드라인 예시 - COVID-19 관련)
- Forbes, B. A., Sahm, D. F., & Weissfeld, A. S. (2014). Bailey & Scott's Diagnostic Microbiology (13th ed.). Mosby Elsevier. (진단미생물학 전반 교과서)
- Tille, P. M. (2017). Bailey & Scott's Diagnostic Microbiology (14th ed.). Elsevier. (진단미생물학 전반 교과서 최신판)
- Miller, J. M., Binnicker, M. J., Campbell, S., Carroll, K. C., Chapin, K. C., Gilligan, P. H., ... & Yao, J. D. (2018). A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2018 update by the Infectious Diseases Society of America and the American Society for Microbiology. Clinical Infectious Diseases, 67(6), e1-e94. (IDSA/ASM 최신 가이드라인 업데이트)
- World Health Organization. (2004). Laboratory biosafety manual (3rd ed.). World Health Organization. (실험실 생물 안전 매뉴얼)
- 질병관리청. 실험실 생물안전 지침. (국내 생물 안전 관련 지침)
- 김양미 외. (2020). 최신 진단미생물학. 정문각. (국내 진단미생물학 교과서)
- 대한진단검사의학회. 진단검사의학 제6판. 범문에듀케이션. (국내 진단검사의학 교과서)
- Garcia, L. S. (Ed.). (2016). Clinical Microbiology Procedures Handbook (4th ed.). ASM Press. (임상 미생물학 절차 핸드북)
- Versalovic, J., Carroll, K. C., Funke, G., Jorgensen, J. H., Landry, M. L., & Warnock, D. W. (Eds.). (2011). Manual of Clinical Microbiology (10th ed.). ASM Press. (임상 미생물학 매뉴얼)
- Leber, A. L. (Ed.). (2016). Clinical Microbiology Procedures Handbook, Volume 1-3. John Wiley & Sons.
- Procop, G. W., Church, D. L., Hall, G. S., Janda, W. M., Koneman, E. W., Schreckenberger, P. C., & Woods, G. L. (2017). Koneman's Color Atlas and Textbook of Diagnostic Microbiology (7th ed.). Wolters Kluwer.
- Mahon, C. R., Lehman, D. C., & Manuselis, G. (2018). Textbook of Diagnostic Microbiology (6th ed.). Saunders.
- Ryan, K. J., & Ray, C. G. (Eds.). (2014). Sherris Medical Microbiology (6th ed.). McGraw Hill Professional.
- Murray, P. R., Rosenthal, K. S., & Pfaller, M. A. (2020). Medical Microbiology (9th ed.). Elsevier.
- Brooks, G. F., Carroll, K. C., Butel, J. S., Morse, S. A., & Mietzner, T. A. (2019). Jawetz Melnick & Adelbergs Medical Microbiology (28th ed.). McGraw Hill Professional.
'임상미생물' 카테고리의 다른 글
| 호기성, 혐기성 균종에 따른 배양 환경과 방법 (1) | 2025.04.17 |
|---|---|
| 세균배양검사를 위한 배지의 종류 (0) | 2025.04.17 |
| 호기성, 혐기성, 편성 혐기성균이란 (2) | 2025.04.16 |
| 미생물 검사 자동화 배양법 (0) | 2025.04.16 |
| 진단검사실에 사용되는 생물학적 안전 상자의 종류와 기능 (1) | 2025.04.15 |




댓글