혹시 원인 모를 감염으로 고생하거나, 처방받은 항생제가 잘 듣지 않아 답답했던 경험이 있으신가요? 혹은 병원에서 여러 검사를 받았지만 명확한 원인을 찾지 못해 치료가 늦어졌던 기억은 없으신지요? 이러한 상황들은 우리 주변에서 생각보다 흔하게 발생합니다. 질병의 정확한 진단과 효과적인 치료를 위해서는 그 원인이 되는 미생물을 정확하게 찾아내는 것이 무엇보다 중요합니다. 그런데, 이 보이지 않는 작은 적, 미생물을 찾아내는 여정의 가장 첫 단추가 바로 '검체 채취'라는 사실, 알고 계셨나요?
많은 분들이 검사는 복잡한 기계와 전문 인력이 담당하는 실험실의 영역이라고만 생각하기 쉽습니다. 물론, 정교한 분석 기술도 중요합니다. 하지만, 아무리 뛰어난 검사 장비와 숙련된 전문가라 할지라도, 처음 채취된 검체 자체가 부적절하다면 정확한 결과를 얻는 것은 불가능합니다. 마치 첫 단추를 잘못 끼우면 옷 전체가 틀어지듯, 잘못된 검체 채취는 진단 과정 전체를 잘못된 방향으로 이끌 수 있습니다. 쉽게 말해, ‘쓰레기가 들어가면 쓰레기가 나온다(Garbage in, garbage out)’는 원칙이 미생물 검사 영역에서는 그 어떤 분야보다 철저하게 적용되는 셈입니다.

이번 시간에는 우리 눈에 보이지 않는 미생물의 세계를 탐험하고, 질병의 원인을 밝혀내는 데 있어 가장 기본적이면서도 결정적인 단계인 '미생물 검체 채취'에 대해 아주 깊이 있고 상세하게 알아보겠습니다. 왜 검체 채취가 그토록 중요한지, 정확한 검사를 위해 반드시 지켜야 할 황금률은 무엇인지, 그리고 흔히 접하는 검체 유형별 올바른 채취 방법과 주의사항은 무엇인지 명확하게 이해하는 시간이 될 것입니다.
또한, 현장에서 자주 발생하는 오류와 검체 품질을 떨어뜨리는 요인들을 살펴봄으로써, 어떻게 하면 더 정확하고 신뢰할 수 있는 검사 결과를 얻을 수 있는지 그 해답을 찾아보겠습니다. 준비되셨나요? 자, 그럼 정확한 진단의 첫걸음, 미생물 검체 채취의 세계로 함께 떠나보시죠!
미생물 검체 채취, 왜 그렇게 중요할까요?
미생물 검체 채취의 정확성은 진단 결과의 신뢰도와 직결되는 가장 핵심적인 요소입니다. 왜 이렇게 강조하는 것일까요? 그 이유는 간단합니다. 부적절하게 채취된 검체는 잘못된 검사 결과를 초래하고, 이는 결국 잘못된 진단과 부적절한 치료로 이어질 수 있기 때문입니다. 이는 단순히 검사 오류를 넘어 환자의 건강에 심각한 위협이 될 수 있으며, 의료 자원의 낭비를 초래하기도 합니다.
아니, 검체 좀 잘못 채취했다고 그렇게 큰 문제가 생기나? 그냥 실험실에서 잘 걸러내면 되는 거 아닌가?
얼핏 생각하면, 실험실의 첨단 기술로 어느 정도 보완이 가능할 것이라고 생각하실 수도 있습니다. 하지만, 실상은 전혀 그렇지 않습니다. 한 번 잘못 채취된 검체는 실험실에서 아무리 노력해도 그 오류를 완벽하게 바로잡기 어렵습니다. 예를 들어, 검체 채취 과정에서 주변 피부나 환경에 있던 오염균(Contaminant)이 섞여 들어갔다고 가정해 봅시다.
실험실에서는 이 오염균과 실제 감염 원인균을 명확하게 구분하기 어려울 수 있습니다. 특히, 오염균이 실제 병원균보다 더 잘 자라는 경우, 검사 결과는 오염균만 검출된 것으로 나올 수 있습니다. 이 경우, 의사는 실제 감염 원인균이 아닌 오염균에 대한 치료를 시작할 수 있으며, 이는 당연히 치료 실패로 이어질 것입니다.
마치 범죄 현장에서 증거를 수집하는 상황을 떠올려 보면 이해하기 쉽습니다. 정확한 범인을 잡기 위해서는 범행 현장에서 범인의 DNA나 지문 같은 결정적인 증거를 오염되지 않게, 충분한 양으로, 정확한 위치에서 채취해야 합니다. 만약 증거 채취 과정에서 다른 사람의 지문이 묻거나, 증거물이 훼손되거나, 엉뚱한 곳에서 증거를 찾는다면 어떻게 될까요? 당연히 수사는 엉뚱한 방향으로 흘러가고 진범을 놓치게 될 것입니다. 미생물 검체 채취도 이와 정확히 같습니다. 환자의 몸이라는 '사건 현장'에서 '범인'인 병원균을 정확히 찾아내기 위한 '증거 수집' 과정이며, 이 과정에서의 실수는 진단과 치료라는 '수사' 전체를 실패로 이끌 수 있습니다.
구체적으로 부적절한 검체 채취가 가져올 수 있는 문제점들을 살펴보겠습니다.
- 잘못된 미생물 동정 (Incorrect Organism Identification): 오염균이 실제 병원균으로 오인되거나, 실제 병원균이 검출되지 않아 감염이 없다고 판단될 수 있습니다. 예를 들어, 혈액 배양 검사 시 피부 소독이 제대로 이루어지지 않으면 피부 상재균인 표피포도알균(Staphylococcus epidermidis)과 같은 균이 흔하게 오염되는데, 이를 실제 균혈증으로 오인하여 불필요한 항생제 치료를 받게 될 수 있습니다 [1].
- 항생제 감수성 결과 오류 (Erroneous Susceptibility Results): 만약 잘못된 균이 동정되었다면, 해당 균에 대한 항생제 감수성 검사 결과는 당연히 임상적으로 아무런 의미가 없습니다. 또한, 검체에 여러 종류의 균이 섞여 있는 경우 정확한 감수성 패턴을 파악하기 어려울 수 있습니다.
- 치료 지연 또는 실패 (Delayed or Failed Treatment): 잘못된 진단은 당연히 부적절한 치료로 이어집니다. 실제 원인균에 효과가 없는 항생제가 사용되거나, 필요한 치료가 늦어져 환자의 상태가 악화될 수 있습니다. 이는 입원 기간 연장, 의료비 상승, 심한 경우 생명에 위협이 될 수도 있습니다.
- 불필요한 추가 검사 및 비용 증가 (Unnecessary Additional Testing and Increased Costs): 초기 검사 결과가 불분명하거나 임상 양상과 맞지 않으면, 원인을 찾기 위해 추가적인 검사를 반복하게 됩니다. 이는 환자의 불편을 가중시키고 의료 비용 부담을 증가시키는 결과를 낳습니다.
- 항생제 내성 확산 기여 (Contribution to Antimicrobial Resistance): 부정확한 검사 결과는 광범위 항생제의 남용을 부추길 수 있습니다. 특정 원인균을 정확히 알지 못하면, 의사는 혹시 모를 다양한 가능성을 염두에 두고 여러 종류의 균에 효과가 있는 강력한 항생제를 우선적으로 사용하게 될 가능성이 높습니다. 이러한 광범위 항생제의 빈번한 사용은 항생제 내성균(Antibiotic-Resistant Bacteria)의 출현과 확산을 가속화하는 주요 원인 중 하나입니다 [2].
이처럼, 미생물 검체 채취는 단순한 준비 단계가 아니라, 정확한 진단과 효과적인 치료를 위한 가장 근본적이고 필수적인 과정입니다. 따라서 검체를 채취하는 모든 의료인은 이 과정의 중요성을 깊이 인식하고, 표준화된 지침에 따라 세심한 주의를 기울여야 합니다. 그렇다면, 정확한 검사를 위해 우리가 반드시 따라야 할 황금률, 즉 기본 원칙들은 무엇일까요? 다음 섹션에서 자세히 알아보겠습니다.
정확한 검사를 위한 황금률: 미생물 검체 채취의 기본 원칙
정확한 미생물 검사 결과를 얻기 위한 여정은 철저한 기본 원칙 준수에서 시작됩니다. 마치 튼튼한 건물을 짓기 위해 기초 공사가 중요하듯, 신뢰할 수 있는 검사 결과를 위해서는 검체 채취 단계에서의 기본 원칙을 철저히 지키는 것이 필수적입니다. 이 원칙들은 검체 내 실제 병원균의 생존력을 유지하고 회수율을 최대화하는 동시에, 외부 오염 가능성을 최소화하여 검사 결과의 정확성을 높이는 것을 목표로 합니다. 자, 그럼 미생물 검체 채취 시 반드시 기억해야 할 6가지 황금률을 하나씩 자세히 살펴볼까요?
무균술(Aseptic Technique)의 철저한 준수

무균술은 검체 채취 과정에서 외부 미생물에 의한 오염을 방지하기 위한 일련의 절차를 의미합니다. 우리의 피부, 점막, 그리고 주변 환경에는 수많은 미생물이 존재합니다. 이러한 미생물들이 검체에 섞여 들어가면 실제 감염 부위에 존재하는 병원균과 혼동을 일으켜 검사 결과를 왜곡시킬 수 있습니다. 따라서 검체 채취 전 손 위생을 철저히 하고, 소독된 장갑을 착용하며, 멸균된 채취 도구와 용기를 사용하는 것이 기본 중의 기본입니다.
특히, 혈액 배양이나 뇌척수액 채취와 같이 본래 무균 상태여야 하는 부위에서 검체를 채취할 때는 더욱 엄격한 무균술이 요구됩니다. 예를 들어, 혈액 배양 시에는 채혈 부위 피부를 단순히 알코올 솜으로 한 번 닦는 것만으로는 부족합니다.
피부에는 깊숙이 상주하는 세균들이 있기 때문에, 알코올과 클로르헥시딘(Chlorhexidine) 또는 포비돈-아이오다인(Povidone-iodine)과 같은 소독제를 순서대로 사용하여 충분한 시간 동안(보통 30초 이상) 마찰하며 소독하고, 소독제가 완전히 마를 때까지 기다려야 합니다 [3]. 왜 이렇게 복잡한 과정을 거칠까요? 이는 피부 표면뿐만 아니라 모낭 등에 존재하는 상재균(Resident flora)까지 효과적으로 제거하여 오염 가능성을 최소화하기 위함입니다. 소독제가 마르기 전에 채혈하면 소독 효과가 떨어질 뿐만 아니라, 소독제가 혈액 검체로 유입되어 검사 결과에 영향을 줄 수도 있습니다.
적절한 시기(Right Time)의 검체 채취
검체 채취 시점은 검사 결과의 정확성에 큰 영향을 미칩니다. 일반적으로 항생제 투여 전에 검체를 채취하는 것이 가장 이상적입니다. 왜냐하면 항생제는 세균의 성장이나 생존을 억제하기 때문에, 항생제 투여 후에는 검체에서 원인균을 검출하기 어려워질 수 있기 때문입니다. 만약 환자가 이미 항생제를 투여받고 있다면, 가능한 다음 항생제 투여 직전에 검체를 채취하는 것이 그나마 검출률을 높일 수 있는 방법입니다.
또한, 질병의 경과에 따라 병원균의 수나 활동성이 달라질 수 있으므로, 증상이 가장 특징적으로 나타나는 시점에 검체를 채취하는 것이 좋습니다. 예를 들어, 균혈증(Bacteremia)이 의심될 때는 환자가 오한과 함께 체온이 급격히 상승하는 시점에 혈액 배양 검사를 시행하는 것이 검출률을 높일 수 있다고 알려져 있습니다 [4]. 폐렴이 의심될 때 객담 검사를 한다면, 아침 첫 객담이 밤새 기관지에 고여 있던 분비물을 포함하고 있어 더 많은 균을 포함할 가능성이 높습니다. 이처럼 질병의 특성과 환자의 상태를 고려하여 최적의 채취 시점을 선택하는 것이 중요합니다.
정확한 부위(Right Site)의 검체 채취
미생물은 감염이 발생한 특정 부위에 집중되어 있는 경우가 많습니다. 따라서 실제 감염이 진행되고 있는 정확한 부위에서 검체를 채취하는 것이 원인균을 찾아낼 확률을 높이는 핵심입니다. 예를 들어, 피부 농양(Abscess)이 있는 경우, 표면에 흘러나온 고름(Pus)만 채취하는 것보다, 주변 피부를 소독한 후 주사기로 농양 깊숙한 곳의 내용물을 흡인(Aspiration)하여 채취하는 것이 훨씬 정확합니다. 표면의 고름에는 이미 죽은 균이나 이차적인 오염균이 섞여 있을 가능성이 높기 때문입니다.
마찬가지로, 욕창이나 당뇨병성 족부 궤양과 같은 만성적인 상처 부위에서 검체를 채취할 때는, 단순히 상처 표면을 면봉으로 문지르는 것(Superficial swab)은 권장되지 않습니다. 상처 표면에는 다양한 종류의 세균들이 단순히 집락(Colonization)을 이루고 있을 뿐, 실제 감염의 원인과는 무관한 경우가 많기 때문입니다 [5].
이런 경우에는 상처 표면의 괴사 조직이나 오염 물질을 깨끗이 제거한 후, 상처 기저부(Base)나 가장자리(Margin)의 살아있는 조직에서 면봉으로 깊숙이 문지르거나, 가능하면 조직 생검(Tissue biopsy)을 통해 검체를 얻는 것이 가장 이상적입니다. 정확한 부위를 선택하는 것이야말로 불필요한 '소음'을 제거하고 실제 '신호'인 병원균을 찾아내는 지름길입니다.
충분한 양(Sufficient Quantity)의 검체 채취
검체 내 병원균의 수가 적거나, 다양한 종류의 검사를 동시에 진행해야 하는 경우, 충분한 양의 검체를 확보하는 것이 매우 중요합니다. 검체 양이 너무 적으면, 낮은 농도로 존재하는 병원균을 검출하지 못하거나(위음성, False negative), 필요한 모든 검사를 수행하지 못할 수 있습니다.
예를 들어, 성인 혈액 배양 검사 시에는 한 세트당 20~30mL (각 병당 10mL)의 혈액을 채취하는 것이 권장됩니다 [3]. 혈액 내 세균의 농도는 매우 낮을 수 있기 때문에, 충분한 양의 혈액을 배양해야 검출률을 높일 수 있습니다. 연구에 따르면, 채취하는 혈액량이 1mL 증가할 때마다 균 검출률이 약 3%씩 증가한다는 보고도 있습니다 [6].
뇌척수액(CSF) 검사의 경우에도 세균 배양, 그람 염색, 항원 검사, 세포 수 계산, 생화학 검사 등 다양한 검사를 위해 최소 1mL 이상, 때로는 여러 개의 튜브에 나누어 총 5~10mL 정도를 채취해야 할 수도 있습니다. 각 검사법이 요구하는 최소 검체량을 미리 확인하고, 가능한 충분한 양을 확보하려는 노력이 필요합니다.
적절한 채취 도구와 용기(Appropriate Collection Devices and Containers)의 사용

어떤 종류의 검사를 할 것인지, 어떤 종류의 미생물을 찾고자 하는지에 따라 사용해야 하는 채취 도구와 용기가 달라집니다. 모든 검체는 반드시 멸균된 용기에 담아야 하며, 외부 오염을 막기 위해 뚜껑이 잘 닫히고 내용물이 새지 않는 용기를 사용해야 합니다.
특히, 수송 배지(Transport medium)의 사용 여부가 중요한 경우가 많습니다. 면봉(Swab)으로 검체를 채취하는 경우, 일반적인 세균 배양을 위해서는 에임스 배지(Amies medium)나 스튜어트 배지(Stuart medium)와 같은 수송 배지가 포함된 면봉을 사용해야 합니다. 이 배지들은 검체 내 세균이 죽거나 과도하게 증식하는 것을 막아주어 실험실 도착 시까지 생존력을 유지시켜 줍니다. 만약 건조한 면봉(Dry swab)을 사용하면, 특히 수가 적거나 환경 변화에 민감한 세균들은 운송 과정 중에 사멸할 수 있습니다. 반대로, 바이러스나 특정 세균(예: 클라미디아, 마이코플라스마) 검사를 위해서는 바이러스 수송 배지(VTM, Viral Transport Medium)나 특수 수송 배지가 필요합니다. 혐기성 세균(Anaerobe) 배양이 필요한 경우에는 공기 노출을 최소화할 수 있는 혐기성 수송 용기나 주사기를 사용해야 합니다. 검사 목적에 맞는 올바른 용기와 수송 배지를 선택하는 것이 검사의 성패를 가를 수 있습니다.
정확한 표기(Proper Labeling)와 신속하고 올바른 운송(Proper Transport)
검체 용기에는 반드시 정확한 환자 정보(이름, 등록번호 등), 검체 종류(예: 혈액, 소변, 객담), 채취 부위(예: 좌측 팔 정맥, 농양 부위), 그리고 채취 날짜와 시간을 정확하게 기재해야 합니다. 이때, 라벨은 용기 본체에 부착해야 하며, 뚜껑에 부착하면 뚜껑이 바뀌거나 분실될 경우 검체가 뒤바뀌는 치명적인 오류가 발생할 수 있습니다. 부정확하거나 누락된 정보는 검사 결과를 해당 환자와 연결시키지 못하게 하거나, 실험실에서 부적절한 검사를 진행하게 만들 수 있습니다.
채취된 검체는 가능한 한 빨리 실험실로 운송해야 합니다. 운송이 지연되면 검체 내 미생물의 수가 변할 수 있습니다. 오염균이 과도하게 증식하거나, 반대로 환경에 민감한 병원균이 사멸할 수 있기 때문입니다 [7]. 이상적인 운송 시간은 검체 종류에 따라 다르지만, 대부분 2시간 이내에 실험실에 도착하는 것이 좋습니다. 만약 운송 지연이 불가피하다면, 검체의 종류에 따라 적절한 온도에서 보관해야 합니다. 예를 들어, 소변 검체는 2시간 이상 지연될 경우 냉장 보관(2~8°C)하여 세균 증식을 억제해야 합니다. 하지만 뇌척수액(CSF)이나 혐기성 배양 검체, 임균(Neisseria gonorrhoeae) 배양 검체 등은 냉장 보관 시 균이 사멸할 수 있으므로 실온에서 보관 및 운송해야 합니다. 각 검체별 권장 보관 온도와 운송 조건을 숙지하고 준수하는 것이 매우 중요합니다.
아래 표는 지금까지 설명한 미생물 검체 채취의 6가지 기본 원칙을 요약한 것입니다.
| 원칙 | 핵심 내용 | 이유 | 예시 |
|---|---|---|---|
| 1. 무균술 (Aseptic Technique) | 외부 미생물 오염 방지 | 검사 결과 왜곡 방지, 실제 병원균만 검출 | 손 위생, 멸균 장갑/도구/용기 사용, 철저한 피부 소독 (혈액 배양) |
| 2. 적절한 시기 (Right Time) | 항생제 투여 전, 증상 발현 시 채취 | 병원균 검출률 최대화, 항생제 영향 최소화 | 항생제 투여 전 채취, 열 날 때 혈액 배양, 아침 첫 객담 채취 |
| 3. 정확한 부위 (Right Site) | 실제 감염 부위에서 채취 | 원인균 검출 확률 증대, 표재성 오염균/집락균 배제 | 농양 흡인, 상처 기저부/가장자리 채취 (표면 괴사조직 제거 후) |
| 4. 충분한 양 (Sufficient Quantity) | 검사 종류 및 병원균 농도 고려하여 적절한 양 확보 | 낮은 농도 병원균 검출률 향상, 필요한 모든 검사 수행 가능 | 성인 혈액 배양 (세트당 20-30mL), CSF (최소 1mL 이상, 필요시 추가) |
| 5. 적절한 도구/용기 (Appropriate Device/Container) | 멸균 용기, 검사 목적 맞는 수송 배지 사용 | 검체 오염/누출 방지, 병원균 생존력 유지 | 세균 배양용 수송 배지 면봉, 바이러스 VTM, 혐기성 수송 용기 |
| 6. 정확한 표기/운송 (Proper Labeling/Transport) | 정확한 정보 기재 (환자, 검체, 시간 등), 신속/적정 온도 운송 | 환자 오인 방지, 적절한 검사 진행, 병원균 생존/증식 변화 최소화 | 용기 본체 라벨링, 2시간 내 운송 (소변 냉장, CSF 실온) |
이 6가지 황금률은 모든 미생물 검체 채취의 기본이자 핵심입니다. 이 원칙들을 철저히 이해하고 실천하는 것이야말로 정확한 진단과 효과적인 치료의 시작이라고 할 수 있습니다. 이제 이러한 기본 원칙을 바탕으로, 우리가 임상 현장에서 흔히 접하게 되는 주요 검체 유형별 채취 방법에 대해 더 자세히 알아보겠습니다.
흔히 접하는 검체 유형별 채취 방법 상세 분석
미생물 검체 채취의 기본 원칙은 모든 검체에 공통적으로 적용되지만, 각 검체의 특성과 채취 부위, 그리고 의심되는 감염 질환에 따라 구체적인 채취 방법과 주의사항은 달라집니다. 마치 각기 다른 요리에는 그에 맞는 재료 손질법과 조리법이 있듯이, 다양한 종류의 미생물 검체 역시 각각의 '레시피'를 따라야 최상의 결과를 얻을 수 있습니다. 이번 섹션에서는 임상에서 가장 흔하게 접하는 주요 검체 유형별로 올바른 채취 방법과 핵심 고려 사항들을 아주 상세하게 파헤쳐 보겠습니다.
혈액 배양 (Blood Culture)
혈액 배양 검사는 혈액 내에 세균이나 진균이 존재하는지 확인하는 검사로, 패혈증(Sepsis)과 같은 중증 감염 질환 진단에 있어 절대적으로 중요한 검사입니다. 혈액은 정상적으로 무균 상태이므로, 혈액 배양에서 미생물이 자란다는 것은 심각한 감염 상태를 의미할 수 있습니다. 하지만 동시에, 혈액 배양 검사는 피부 상재균에 의한 오염(Contamination)이 가장 흔하게 발생하는 검사 중 하나이기도 합니다 [1]. 따라서 오염을 최소화하기 위한 철저한 무균술 준수가 그 무엇보다 중요합니다.
피부 소독만 잘하면 되는 거 아닌가? 뭐가 그렇게 복잡하지?
단순히 소독만 잘한다고 끝나는 문제가 아닙니다. 혈액 배양의 정확도를 높이기 위해서는 여러 가지 요소를 복합적으로 고려해야 합니다.

- 채혈 부위 선정: 일반적으로 정맥 주사 경로(Intravenous line)가 없는 팔의 정맥에서 채혈하는 것이 가장 좋습니다. 이미 삽입된 카테터에서 채혈하면 카테터 자체에 집락된 균에 의해 오염될 가능성이 높기 때문입니다. 만약 카테터 관련 혈류 감염(Catheter-related bloodstream infection, CRBSI)이 의심된다면, 말초 정맥과 의심되는 카테터에서 동시에 혈액을 채취하여 배양 양성까지 걸리는 시간(Differential time-to-positivity, DTP)을 비교하는 방법이 진단에 도움이 될 수 있습니다 [8].
- 피부 소독: 가장 핵심적인 단계입니다. 70% 알코올로 먼저 채혈 부위를 닦아내어 표면의 오염 물질을 제거한 후, 2% 클로르헥시딘(Chlorhexidine) 또는 10% 포비돈-아이오다인(Povidone-iodine)을 이용하여 중심부에서 바깥쪽으로 원을 그리며 넓게(직경 약 5-7cm) 소독합니다. 이때, 최소 30초 이상 충분히 마찰하는 것이 중요하며, 소독제가 완전히 마를 때까지(클로르헥시딘 약 30초, 포비돈 약 1.5-2분) 기다려야 합니다. 소독제가 마르면서 살균 효과를 나타내기 때문입니다. 소독 후에는 다시 손으로 만지거나 알코올로 닦아내서는 절대 안 됩니다. 만약 만져야 한다면 멸균 장갑을 착용한 손가락으로 소독된 부위 바깥쪽을 만져 위치를 확인합니다.
- 채혈량: 성인의 경우, 한 번의 채혈 시(한 세트) 총 20~30mL의 혈액을 채취하여 호기성(Aerobic) 배양 병과 혐기성(Anaerobic) 배양 병에 각각 10mL씩 나누어 접종하는 것이 표준입니다 [3]. 소아의 경우는 체중에 따라 권장 채혈량이 다르므로, 병원의 지침을 따라야 합니다. 충분한 혈액량 확보는 검출률을 높이는 데 매우 중요합니다. 혈액량이 부족하면 위음성 결과가 나올 확률이 높아집니다.
- 채혈 세트 수: 패혈증이 의심되는 성인 환자에서는 일반적으로 서로 다른 부위에서 최소 2세트(총 4병)의 혈액 배양 검사를 시행하는 것이 권장됩니다 [4]. 왜 여러 세트를 채취할까요? 첫째, 균혈증이 간헐적으로 나타날 수 있으므로 검출 기회를 높이기 위함입니다. 둘째, 여러 세트에서 동일한 균이 자랄 경우, 단순 오염보다는 실제 균혈증일 가능성이 훨씬 높다고 판단할 수 있기 때문입니다. 예를 들어, 한 세트에서만 표피포도알균이 자랐다면 오염일 가능성이 높지만, 두 세트 이상에서 모두 자랐다면 실제 감염을 시사할 수 있습니다.
- 접종 순서: 주사기를 이용하여 채혈한 경우, 일반적으로 호기성 배양 병에 먼저 혈액을 접종하고, 그 다음 혐기성 배양 병에 접종합니다. 이는 주사기 내에 남아있을 수 있는 공기가 혐기성 배양 환경에 영향을 미치는 것을 최소화하기 위함입니다. 만약 나비 바늘(Butterfly needle)과 진공 채혈관 홀더를 사용하는 경우에는, 혐기성 병에 먼저 접종하여 튜브 내 공기를 제거한 후 호기성 병에 접종하는 것이 권장되기도 합니다.
- 운송: 채취된 혈액 배양 병은 실온에서 보관하며 가능한 한 빨리(보통 2시간 이내) 검사실로 운송해야 합니다. 냉장 보관은 절대 금물입니다.
Clinical and Laboratory Standards Institute (CLSI)의 GP41 가이드라인은 혈액 배양 검체를 위한 채취 절차에 대한 자세한 표준 지침을 제공하고 있으므로, 의료기관에서는 이 지침을 참고하여 자체 프로토콜을 마련하고 직원 교육을 시행하는 것이 중요합니다 [3].
소변 검체 (Urine Specimen)
소변 검체는 요로 감염(Urinary tract infection, UTI) 진단을 위해 가장 흔하게 의뢰되는 검체 중 하나입니다. 하지만 소변은 배설 과정에서 요도 주변의 피부나 질 분비물 등에 의해 쉽게 오염될 수 있어, 정확한 결과를 얻기 위해서는 올바른 채취 방법이 매우 중요합니다. 목표는 방광 내에 존재하는 실제 병원균을 최대한 반영하고, 외부 오염균의 혼입을 최소화하는 것입니다.

- 중간뇨 청결 채취 (Midstream Clean-Catch Urine): 가장 일반적으로 사용되는 방법입니다.
- 여성: 먼저 비누와 물 또는 소독 티슈로 외음부를 앞에서 뒤 방향으로 닦아냅니다. 여러 번 닦아야 하며, 매번 새로운 티슈를 사용합니다. 음순을 벌린 상태에서 소변을 보기 시작하여, 처음 나오는 소변 일부는 버리고 중간 부분의 소변을 멸균 용기에 받습니다. 마지막 소변도 버립니다. 왜 처음과 마지막 소변을 버릴까요? 처음 소변에는 요도 입구 주변의 상재균이 섞여 나올 수 있고, 마지막 소변은 방광 내 깊숙한 곳의 상태를 잘 반영하지 못할 수 있기 때문입니다.
- 남성: 포경수술을 하지 않은 경우, 포피를 뒤로 젖히고 귀두 부위를 비누와 물 또는 소독 티슈로 닦아냅니다. 소변을 보기 시작하여 처음 나오는 소변은 버리고 중간 소변을 멸균 용기에 받습니다.
- 주의사항: 용기 입구나 안쪽 면이 피부에 닿지 않도록 주의해야 합니다. 채취 후에는 즉시 뚜껑을 단단히 닫습니다.
- 인공 도뇨관 채취 (Catheterized Urine): 스스로 소변을 보기 어려운 환자나 오염 가능성을 최소화해야 할 경우 시행합니다.
- 단순 도뇨 (Straight Catheterization): 요도를 통해 방광까지 일시적으로 카테터를 삽입하여 소변을 채취하는 방법입니다. 무균적으로 시행하면 오염 가능성이 가장 적은 방법 중 하나입니다.
- 유치 도뇨관 (Indwelling Catheter): 이미 유치 도뇨관을 가지고 있는 환자의 경우, 소변 주머니(Urine bag)에서 검체를 채취해서는 절대 안 됩니다. 소변 주머니 속 소변은 오래되어 세균이 증식했을 가능성이 높기 때문입니다. 반드시 카테터의 채취 포트(Sampling port)를 소독한 후, 주사기를 이용하여 무균적으로 채취해야 합니다. 채취 전 카테터를 잠시 잠가두면(약 15-30분) 신선한 소변을 얻는 데 도움이 될 수 있습니다.
- 방광 천자 (Suprapubic Aspiration): 가장 오염 가능성이 적은 '최상의' 검체이지만, 침습적인 방법이므로 주로 영유아나 특수한 경우에만 시행됩니다. 복벽을 통해 방광으로 직접 주사 바늘을 삽입하여 소변을 채취합니다.
- 운송 및 보관: 채취된 소변 검체는 2시간 이내에 실험실로 운송하는 것이 원칙입니다. 만약 지연될 경우, 냉장(2~8°C) 보관하거나 소변 보존제(예: 붕산, Boric acid)가 포함된 용기를 사용해야 합니다 [9]. 실온에 방치하면 검체 내 세균이 증식하여 실제보다 높은 세균 수를 보여 요로 감염으로 잘못 진단될 수 있습니다. CLSI GP16 가이드라인은 소변 검체 관리 및 운송에 대한 지침을 제공합니다 [9].
호흡기 검체 (Respiratory Specimens)

호흡기 감염 진단을 위해서는 감염 부위에 따라 다양한 종류의 검체를 채취하게 됩니다. 상기도 감염(인후염, 비염 등)과 하기도 감염(기관지염, 폐렴 등)에 따라 주로 사용되는 검체와 채취 방법이 다릅니다.
- 인후 도찰 검체 (Throat Swab): 주로 A군 연쇄상구균(Group A Streptococcus)에 의한 인두염 진단을 위해 시행됩니다. 혀 압자(Tongue depressor)로 혀를 누르고, 면봉으로 양쪽 편도(Tonsil)와 인두 후벽(Posterior pharynx)의 발적되거나 삼출물이 있는 부위를 강하게 문질러 채취합니다. 이때 혀, 볼 점막, 치아 등 다른 부위에 면봉이 닿지 않도록 주의해야 구강 내 상재균 오염을 줄일 수 있습니다. 채취된 면봉은 즉시 수송 배지에 넣어 운송합니다.
- 비인두 도찰/흡인 검체 (Nasopharyngeal Swab/Aspirate): 인플루엔자, 호흡기 세포융합 바이러스(RSV), 코로나19(COVID-19)와 같은 바이러스 감염이나 백일해(Pertussis) 진단에 주로 사용됩니다.
- 도찰(Swab): 유연한 재질의 가는 면봉을 사용하여 콧구멍을 통해 비강 바닥과 평행하게 부드럽게 삽입하여 비인두 후벽까지 도달시킨 후, 몇 초간 그대로 두거나 부드럽게 돌려 점막 세포를 채취합니다. 깊이가 중요하며, 성인의 경우 약 5~7cm 정도 삽입됩니다.
- 흡인(Aspirate): 부드러운 카테터를 비인두까지 삽입한 후, 소량의 멸균 생리식염수를 주입하고 즉시 흡인하여 검체를 얻습니다. 도찰법보다 더 많은 양의 검체를 얻을 수 있어 민감도가 높을 수 있으나, 시행이 더 번거로울 수 있습니다. 채취된 검체는 바이러스 수송 배지(VTM)에 넣어 운송합니다.
- 객담 (Sputum): 폐렴과 같은 하기도 감염 진단에 중요한 검체입니다. 객담의 질(Quality)이 검사 결과의 신뢰도에 결정적인 영향을 미칩니다. 단순히 침이나 구강 분비물이 아닌, 폐와 기관지 깊은 곳에서 나온 가래여야 합니다.
- 채취 방법: 이른 아침, 잠에서 깬 직후의 첫 객담이 가장 좋습니다. 환자에게 양치질을 먼저 하여 구강 내 음식물 찌꺼기나 세균을 줄이도록 안내합니다 (단, 구강청결제 사용은 피함). 심호흡을 몇 번 한 후, 깊게 기침하여 폐 깊숙한 곳에서 나오는 객담을 멸균 용기에 뱉도록 합니다. 침(Saliva)이 섞이지 않도록 주의합니다.
- 객담의 질 평가: 실험실에서는 객담 검체를 받으면 그람 염색(Gram stain)을 통해 검체의 질을 평가합니다. 백혈구(PMN)가 많고 편평상피세포(Squamous epithelial cell)가 적을수록 하기도에서 유래한 좋은 질의 객담으로 간주합니다 [10]. 편평상피세포가 많다는 것은 침이나 구강 분비물이 많이 섞였다는 의미이며, 이런 검체는 검사 결과의 신뢰도가 낮아 재채취를 요구할 수 있습니다.
- 유도 객담 (Induced Sputum): 스스로 객담 배출이 어려운 경우, 고농도 식염수를 분무 흡입시켜 인위적으로 기침을 유발하여 객담을 채취하는 방법입니다.
- 기관지 폐포 세척액 (Bronchoalveolar Lavage, BAL) / 기관지 세척액 (Bronchial Washings): 기관지 내시경을 통해 폐 깊숙한 곳까지 접근하여 멸균 생리식염수로 세척하고 흡인하여 얻는 검체입니다. 객담 검사보다 더 정확하게 하기도 감염 원인균을 진단할 수 있으며, 특히 면역 저하 환자나 중증 폐렴 환자에게 유용합니다. 침습적인 시술이므로 반드시 숙련된 의사가 시행해야 합니다. 정량 배양(Quantitative culture)을 통해 집락균과 실제 병원균을 감별하는 데 도움을 받을 수 있습니다.
상처 및 농양 검체 (Wound and Abscess Specimens)
상처 감염은 매우 흔하며, 정확한 원인균 동정은 적절한 항생제 선택과 상처 관리에 필수적입니다. 하지만 상처 부위는 외부 환경에 노출되어 있거나 다양한 세균이 집락하고 있는 경우가 많아, 실제 감염을 일으키는 병원균과 단순 오염균 또는 집락균을 구별하는 것이 중요합니다.
- 표재성 상처 (Superficial Wounds):
- 채취 전 준비: 먼저 멸균 생리식염수나 소독제로 상처 표면의 괴사 조직, 삼출물, 농 등을 깨끗하게 닦아냅니다. 이는 표면에 있는 오염균이나 집락균을 제거하기 위함입니다.
- 채취 방법: 멸균 면봉을 이용하여 상처 기저부(base)나 활동적으로 감염이 진행되는 가장자리(advancing margin)의 살아있는 조직을 압력을 주면서 회전시켜 문지릅니다. Z자 형태로 문지르거나 여러 부위를 채취하는 것이 좋습니다. 건조한 가피(eschar)나 단순히 고여 있는 농(pus)만 채취하는 것은 피해야 합니다. 채취된 면봉은 즉시 수송 배지에 넣습니다.
- 심부 상처 및 농양 (Deep Wounds and Abscesses):
- 최선의 방법은 흡인 (Aspiration): 가능하다면 면봉보다는 주사기와 바늘을 이용한 흡인 검체가 훨씬 우수합니다. 특히, 혐기성 세균(Anaerobe) 감염이 의심될 때는 공기 노출을 최소화할 수 있는 흡인법이 필수적입니다. 주변 피부를 철저히 소독한 후, 주사기로 농양이나 심부 조직액을 흡인합니다. 흡인된 검체는 공기가 들어가지 않도록 바늘 끝을 고무마개로 막거나, 즉시 혐기성 수송 용기(Anaerobic transport vial)에 옮겨 담습니다.
- 면봉 사용 시: 흡인이 불가능한 경우에 한해 면봉을 사용합니다. 표면 소독 후, 면봉을 상처 깊숙이 삽입하여 조직액이나 농을 채취합니다. 혐기성 감염이 의심되면 혐기성 수송 배지가 포함된 면봉을 사용해야 합니다.
- 조직 생검 (Tissue Biopsy): 만성 상처(예: 당뇨병성 족부 궤양), 골수염(Osteomyelitis), 또는 심부 감염 진단에는 조직 생검이 가장 정확한 방법(Gold standard)입니다 [11]. 외과적 시술을 통해 감염된 조직의 일부를 절제하여 배양 검사를 시행합니다. 조직 검체는 멸균 용기에 담아 건조하지 않게 멸균 생리식염수를 약간 적셔 운송합니다. 포르말린(Formalin) 용액에 담그면 미생물이 사멸하므로 절대 사용해서는 안 됩니다.
뇌척수액 (Cerebrospinal Fluid - CSF)
뇌척수액 검사는 뇌수막염(Meningitis)이나 뇌염(Encephalitis)과 같은 중추신경계 감염 진단에 결정적인 역할을 합니다. CSF는 정상적으로 무균 상태이며, 감염 시 세균, 바이러스, 진균 등이 검출될 수 있습니다. CSF 검체는 매우 중요하고 응급을 요하는 검체(STAT specimen)이므로, 채취부터 검사까지 모든 과정이 신속하고 정확하게 이루어져야 합니다.
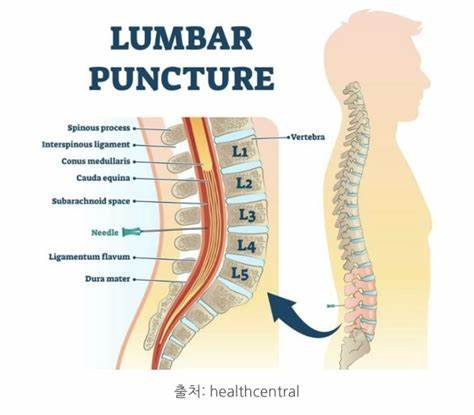
- 채취: 요추 천자(Lumbar puncture)를 통해 의사가 무균적으로 채취합니다. 보통 3~4개의 멸균 튜브에 순서대로 CSF를 받습니다. 일반적으로 첫 번째 튜브는 생화학/면역 검사용, 두 번째 튜브는 미생물 검사용(배양, 염색 등), 세 번째 튜브는 세포 수 계산/혈액학 검사용으로 사용됩니다 [12]. 왜 순서를 지킬까요? 천자 과정에서 미세한 출혈이 발생할 수 있는데, 첫 번째 튜브에 혈액이 가장 많이 섞일 수 있으므로, 혈액 혼입에 가장 민감한 세포 수 계산은 마지막 튜브로 검사하고, 미생물 배양은 중간 튜브를 사용하는 것이 일반적입니다. 튜브 번호와 채취 순서를 정확히 기록하는 것이 중요합니다.
- 운송: 채취 즉시, 지체 없이 실험실로 운송해야 합니다. 운송 온도는 실온(Room temperature)을 유지해야 합니다. 왜 냉장 보관하면 안 될까요? 뇌수막염의 주요 원인균 중 하나인 수막알균(Neisseria meningitidis)이나 헤모필루스 인플루엔자(Haemophilus influenzae)와 같은 일부 세균은 저온에 매우 민감하여 냉장 보관 시 사멸할 수 있기 때문입니다 [12]. 운송이 30분 이상 지연될 것으로 예상되면 검사실에 미리 연락하여 준비하도록 해야 합니다.
대변 검체 (Stool Specimen)
대변 검사는 설사, 장염 등 소화기계 감염의 원인균(세균, 바이러스, 기생충)을 찾기 위해 시행됩니다. 대변에는 원래 수많은 종류의 정상 세균총(Normal flora)이 존재하므로, 이들 사이에서 실제 병원균을 구별해내는 것이 중요합니다.
- 채취: 깨끗하고 건조한 용기(예: 플라스틱 컵이나 특수 대변 채취 용기)에 환자 스스로 배변하여 채취합니다. 소변이나 화장실 물, 휴지 등이 섞이지 않도록 주의해야 합니다. 소변은 세균 성장을 억제할 수 있고, 물이나 휴지는 기생충 검사에 방해가 될 수 있습니다. 용기에 설사변의 경우 약 5
10mL, 형성된 변의 경우 강낭콩 크기(약 12g) 정도를 담습니다. 특히, 혈액이나 점액이 섞인 부분이 있다면 그 부위를 포함하여 채취하는 것이 좋습니다. - 검사 목적에 따른 용기 선택:
- 세균 배양 (Bacterial Culture): 살모넬라(Salmonella), 쉬겔라(Shigella), 캠필로박터(Campylobacter) 등을 검출하기 위한 경우, 신선한 대변을 일반 멸균 용기에 담아 제출합니다. 만약 운송이 2시간 이상 지연될 경우, 캐리-블레어 수송 배지(Cary-Blair transport medium)가 포함된 용기를 사용하여 병원성 세균의 생존을 돕고 정상 세균총의 과증식을 억제해야 합니다.
- 클로스트리듐 디피실 독소 검사 (Clostridioides difficile Toxin Assay): 보존제가 없는 깨끗한 용기에 채취하여 가능한 한 빨리 냉장 상태로 운송합니다. 독소는 실온에서 불안정할 수 있습니다.
- 기생충 검사 (Ova and Parasite Examination, O&P): 기생충 충란이나 원충을 검사하기 위해서는 보존액이 포함된 특수 용기 세트(예: 10% 포르말린 용액, PVA 고정액)를 사용해야 합니다. 보존액은 기생충의 형태를 유지시켜 정확한 동정을 가능하게 합니다. 보존액이 없는 신선한 대변에서는 아메바 영양형(Trophozoite)과 같이 운동성이 있는 원충을 관찰해야 할 수 있으므로, 채취 후 30분 이내에 검사실에 도착해야 합니다. 기생충은 간헐적으로 배출될 수 있으므로, 보통 2~3일 간격으로 총 3회 검체를 채취하는 것이 권장됩니다 [13].
- 바이러스 검사 (Viral Testing): 로타바이러스(Rotavirus), 노로바이러스(Norovirus) 등 바이러스 항원 검사를 위해서는 보존제가 없는 신선한 대변 검체를 사용하며, 냉장 상태로 운송합니다.
- 운송: 검체 종류와 검사 목적에 따라 실온, 냉장, 또는 냉동 상태로 운송해야 합니다. 일반적인 세균 배양은 냉장 운송이 원칙이나, 캐리-블레어 배지를 사용하면 실온 운송도 가능합니다. 독소 검사나 바이러스 검사는 냉장, 장기 보관 시 냉동이 필요할 수 있습니다. 기생충 검체(보존액 포함)는 보통 실온에서 운송합니다.
아래 표는 주요 검체 유형별 핵심 채취 및 운송 지침을 요약한 것입니다.
| 검체 종류 | 주요 채취 방법 | 핵심 고려사항 (용기/보관/운송) | 주의사항 |
|---|---|---|---|
| 혈액 배양 | 말초 정맥 천자 (2세트 이상, 세트당 20-30mL) | 호기성/혐기성 배양 병, 실온 운송 (냉장 금지), 2시간 내 운송 | 철저한 피부 소독 (마찰, 건조 시간 준수), 충분한 혈액량 확보, 라인 오염 주의 |
| 소변 | 중간뇨 청결 채취, 인공 도뇨, (드물게) 방광 천자 | 멸균 용기, 2시간 내 실온 운송 / 지연 시 냉장 보관 또는 보존제 용기 사용 | 외음부/귀두 청결, 처음/마지막 소변 버리기, 소변 주머니 검체 사용 금지 |
| 인후 도찰 | 편도/인두 후벽 발적 부위 강하게 문지르기 | 수송 배지 면봉, 실온 운송 | 혀, 볼 점막 접촉 회피 |
| 비인두 도찰/흡인 | 비강 바닥 따라 비인두 후벽까지 삽입 (도찰) / 식염수 흡인 | 바이러스 수송 배지(VTM) 또는 특수 배지, 냉장 운송 권장 (바이러스 종류 따라 다름) | 적절한 깊이 삽입 중요 |
| 객담 | 아침 첫 객담, 심호흡 후 깊은 기침 유도 | 멸균 용기, 실온 운송 (2시간 내) / 지연 시 냉장 보관 | 침 아닌 하기도 객담 채취, 채취 전 양치 (구강청결제 제외), 질 평가 중요 |
| 상처/농양 | 흡인 (최선), 표면 소독 후 기저부/가장자리 면봉 채취 | 멸균 용기, 수송 배지 면봉, (혐기성 의심 시) 혐기성 수송 용기/면봉, 실온 운송 | 표재성 고름/괴사 조직 피하기, 혐기성균 고려 시 공기 노출 최소화 |
| 뇌척수액(CSF) | 요추 천자 (의사 시행, 3-4개 튜브 순차 채취) | 멸균 튜브, 절대 냉장 금지, 즉시 실온 운송 (STAT) | 튜브 순서 기록, 신속 운송 필수 |
| 대변 | 깨끗한 용기에 배변 (소변/물 오염 방지) | 검사 목적 따라 용기/보관/운송 상이 (세균: Cary-Blair/냉장, 독소: 냉장, 기생충: 보존액/실온, 바이러스: 냉장) | 혈액/점액 포함 부위 채취, 검사 종류별 적합한 용기/보존제/운송 조건 확인 |
이처럼 각 검체 유형별로 최적의 채취 방법과 조건을 이해하고 준수하는 것은 정확한 미생물 검사 결과를 얻기 위한 필수적인 과정입니다. 하지만 이론적으로 완벽한 방법을 숙지하고 있더라도, 실제 임상 현장에서는 얘기치 못한 실수들이 발생하곤 합니다. 다음 섹션에서는 이러한 흔한 오류들과 검체 품질 저하 요인들에 대해 자세히 살펴보겠습니다.
흔히 저지르는 실수와 검체 품질 저하 요인
아무리 강조해도 지나치지 않은 것이 바로 미생물 검체 채취의 정확성입니다. 하지만 안타깝게도 실제 임상 현장에서는 다양한 이유로 오류가 발생하고, 이는 검체 품질 저하로 이어져 결국 진단과 치료에 부정적인 영향을 미치게 됩니다. 이러한 오류는 단순히 개인의 부주의를 넘어, 시스템적인 문제나 교육 부족, 잘못된 관행 등 복합적인 원인에 의해 발생할 수 있습니다. 어떤 실수들이 흔하게 발생하며, 검체 품질을 떨어뜨리는 주요 요인들은 무엇일까요? 이를 명확히 인지하는 것은 오류를 예방하고 개선하기 위한 첫걸음입니다.
오류 1: 오염 (Contamination)
검체 채취 과정에서의 오염은 가장 빈번하게 발생하는 문제이며, 결과 해석에 가장 큰 혼란을 야기하는 주범입니다. 앞서 강조했듯이, 특히 혈액 배양 검사에서 피부 상재균에 의한 오염은 심각한 문제를 일으킵니다. 소변 검체 역시 요도 주변이나 외부 생식기의 균에 의해 쉽게 오염될 수 있으며, 상처 검체는 주변 환경이나 피부의 균에 오염될 가능성이 높습니다.
소독도 하고 멸균 용기도 썼는데 왜 자꾸 오염이 될까?
오염은 생각보다 다양한 경로를 통해 발생할 수 있습니다.
- 부적절한 피부 소독: 소독 범위가 충분히 넓지 않거나, 마찰 시간이 부족하거나, 소독제가 마르기 전에 채취하는 경우.
- 멸균 용기나 도구의 오염: 용기 뚜껑을 열어둔 채 방치하거나, 멸균된 도구를 비멸균 표면에 접촉시키는 경우.
- 채취 기술 미흡: 면봉이나 바늘이 채취 부위 외 다른 곳(예: 혀, 피부)에 닿는 경우.
- 환경적 요인: 공기 중의 낙하균이나 주변 환경 표면으로부터의 오염.
오염을 줄이기 위해서는 표준화된 프로토콜을 철저히 준수하고, 모든 단계에서 무균 개념을 유지하는 것이 중요합니다. 또한, 오염률을 정기적으로 모니터링하고 피드백하는 시스템을 갖추는 것이 도움이 될 수 있습니다 [14].
오류 2: 불충분한 검체량 (Insufficient Quantity)
검체 양이 부족하면 검사 민감도(Sensitivity)가 떨어져 실제 존재하는 병원균을 놓칠 수 있습니다(위음성). 특히 혈액 배양이나 CSF 검사와 같이 병원균의 농도가 낮을 수 있는 검체에서는 충분한 양을 확보하는 것이 더욱 중요합니다. 혈액 배양 병에 혈액을 권장량보다 적게 넣거나, 소변 배양을 위해 너무 적은 양의 소변을 제출하는 경우가 흔한 예입니다. 또한, 다양한 검사를 동시에 진행해야 하는데 검체량이 부족하여 일부 검사를 포기해야 하는 상황도 발생할 수 있습니다.
검체 채취 전에 필요한 검사항목과 각 검사에 요구되는 최소 검체량을 미리 확인하고, 가능한 충분한 양을 확보하도록 노력해야 합니다. 만약 충분한 양을 채취하기 어려운 상황이라면, 검사실과 상의하여 우선순위가 높은 검사부터 진행하도록 조율하는 것이 필요합니다.
오류 3: 부적절한 채취 시기 또는 부위 (Incorrect Timing or Site)
잘못된 시점이나 엉뚱한 부위에서 검체를 채취하면 실제 병원균을 찾아낼 가능성이 현저히 낮아집니다. 이미 항생제 치료를 시작한 후에 혈액 배양 검사를 하거나, 폐렴 환자에게서 침만 가득한 객담 검체를 받거나, 깊은 농양 대신 표면의 고름만 면봉으로 채취하는 경우가 대표적인 예입니다. 이는 마치 범인이 이미 떠난 현장에서 뒤늦게 증거를 찾거나, 엉뚱한 장소에서 수사를 벌이는 것과 같습니다.
질병의 특성과 환자의 상태, 치료 경과 등을 종합적으로 고려하여 최적의 채취 시점과 부위를 신중하게 선택해야 합니다. 필요한 경우, 영상 검사 등을 통해 감염 부위를 정확히 파악하는 것이 도움이 될 수 있습니다. 환자에게 검체 채취의 중요성과 올바른 방법을 충분히 설명하고 협조를 구하는 것도 중요합니다.
오류 4: 잘못된 용기 또는 수송 배지 사용 (Wrong Container or Transport Medium)
검체의 종류와 검사 목적에 맞지 않는 용기나 수송 배지를 사용하면 병원균이 사멸하거나 검사 자체가 불가능해질 수 있습니다. 예를 들어, 혐기성 세균 배양을 위해 일반 면봉을 사용하거나, 기생충 검사를 위해 보존액이 없는 용기에 대변을 담아 제출하는 경우가 그렇습니다. 바이러스 검사를 위해 세균용 수송 배지를 사용하거나, 조직 검체를 포르말린에 담그는 치명적인 실수도 발생할 수 있습니다.
각 검사실에서는 검사 항목별로 요구되는 정확한 용기와 수송 배지에 대한 정보를 명확하게 제공하고, 검체 채취 담당자는 이를 반드시 확인하고 사용해야 합니다. 용기와 배지의 유효기간을 확인하는 것도 잊지 말아야 합니다.
오류 5: 부적절한 보관 및 운송 (Improper Storage and Transport)
채취된 검체를 너무 오랫동안 실온에 방치하거나, 부적절한 온도로 보관 및 운송하면 검체 내 미생물 환경이 크게 변질될 수 있습니다. 실온에서는 오염균이나 빠른 증식 속도를 가진 균들이 과도하게 자라 실제 병원균을 가릴 수 있고(예: 소변 검체), 반대로 냉장 보관 시에는 온도에 민감한 균들이 사멸할 수 있습니다(예: CSF 검체). 운송 지연은 이러한 문제를 더욱 심화시킵니다.
채취된 검체는 최대한 신속하게 검사실로 운송하는 것을 원칙으로 하며, 지연 시에는 각 검체별 권장 보관 온도(실온, 냉장, 냉동)를 철저히 준수해야 합니다. 검체 운송 시스템을 효율화하고, 채취 시간과 운송 시간을 정확히 기록하여 관리하는 것이 중요합니다.
오류 6: 부정확하거나 불충분한 정보 기재 (Inaccurate or Insufficient Labeling)
검체 라벨에 환자 정보가 잘못 기재되거나, 검체 종류나 채취 부위, 채취 시간 등의 정보가 누락되면 검사 결과의 신뢰성에 심각한 문제를 야기합니다. 최악의 경우, 검체가 뒤바뀌어 엉뚱한 환자에게 잘못된 결과가 보고될 수도 있습니다. 이는 환자 안전에 직접적인 위협이 되는 매우 심각한 오류입니다. 또한, 채취 부위 정보가 없으면 검사실에서 어떤 종류의 배지를 사용하고 어떤 균을 중점적으로 찾아야 할지 판단하기 어렵고, 채취 시간 정보가 없으면 결과 해석에 오류가 발생할 수 있습니다(예: 소변 검체에서 세균 수 해석).
검체 채취 직후, 반드시 환자 앞에서 최소 두 가지 이상의 환자 식별 정보(예: 이름, 등록번호)를 확인하며 라벨을 정확하게 부착해야 합니다. 라벨에는 요구되는 모든 정보(환자 정보, 검체 종류, 채취 부위, 채취 일시, 채취자 등)를 명확하고 읽기 쉽게 기재해야 합니다. 바코드 시스템을 활용하면 이러한 오류를 줄이는 데 도움이 될 수 있습니다.
검체 품질 평가와 부적합 검체 처리
많은 임상 미생물 검사실에서는 접수된 검체가 검사에 적합한지 평가하는 절차를 가지고 있습니다. 예를 들어, 객담 검체의 그람 염색 결과를 통해 타액 오염 정도를 평가하거나, 소변 검체의 보관 상태 및 시간을 확인하는 것 등이 해당됩니다. 만약 검체가 부적절하다고 판단되면(예: 심하게 오염되었거나, 양이 너무 적거나, 잘못된 용기에 담겨 왔거나, 정보가 불충분한 경우), 검사실은 해당 검체를 '부적합(Unacceptable)'으로 판정하고 검사를 거부하거나, 재채취를 요청할 수 있습니다 [15].
검사를 거부한다고? 환자가 불편해할 텐데 그냥 해주면 안 되나?
물론 환자의 불편을 최소화하는 것도 중요하지만, 부적합한 검체로 부정확한 결과를 내보내는 것은 환자에게 더 큰 해를 끼칠 수 있습니다. 따라서 검사실의 검체 부적합 기준과 재채취 요청은 검사 결과의 질을 유지하고 환자 안전을 지키기 위한 필수적인 과정으로 이해해야 합니다. 의료진은 이러한 기준을 숙지하고, 부적합 판정을 받았을 경우 그 원인을 파악하여 다음번에는 올바른 검체를 채취할 수 있도록 노력해야 합니다. 검사실과 임상 현장 간의 원활한 의사소통과 협력이 중요합니다.
지금까지 미생물 검체 채취 시 흔히 발생하는 오류들과 검체 품질 저하 요인들에 대해 살펴보았습니다. 이러한 문제점들을 명확히 인식하고 개선하려는 노력이 뒷받침될 때, 비로소 우리는 미생물 검사 결과의 신뢰도를 높이고 환자에게 최상의 의료 서비스를 제공할 수 있을 것입니다.
결론: 정확한 진단은 올바른 검체 채취에서 시작된다
지금까지 우리는 미생물 검체 채취의 중요성부터 시작하여, 정확한 검사를 위한 기본 원칙, 주요 검체 유형별 상세 채취 방법, 그리고 흔히 발생하는 오류와 품질 저하 요인까지 폭넓고 깊이 있게 살펴보았습니다. 이 모든 내용을 관통하는 단 하나의 핵심 메시지는 명확합니다. 바로, 정확하고 신뢰할 수 있는 미생물 검사 결과는 다른 무엇도 아닌, 올바르고 세심하게 수행된 검체 채취에서 시작된다는 것입니다.
우리는 검체 채취의 6가지 황금률 - 무균술 준수, 적절한 시기 선택, 정확한 부위 공략, 충분한 양 확보, 올바른 도구와 용기 사용, 그리고 정확한 표기와 신속/적정 온도 운송 - 이 왜 중요한지 그 이유와 구체적인 방법들을 확인했습니다. 혈액 배양에서의 철저한 피부 소독의 중요성, 소변 검체에서 오염을 최소화하는 방법, 객담 검체에서 '질 좋은' 검체를 얻기 위한 노력, 상처 검체에서 표면이 아닌 깊은 곳을 목표로 해야 하는 이유, 그리고 CSF나 대변 검체처럼 특수한 조건이 요구되는 경우까지, 각 검체 유형별 '맞춤 전략'의 필요성을 이해했습니다.
또한, 오염, 불충분한 양, 잘못된 시기나 부위 선택, 부적절한 용기 사용, 운송 오류, 부정확한 정보 기재와 같은 흔한 실수들이 어떻게 검사 결과를 왜곡시키고 환자 치료에 악영향을 미칠 수 있는지 명확히 인지하게 되었습니다. 이러한 오류는 단순히 개인의 실수가 아니라, 우리 모두가 주의를 기울이고 시스템적으로 개선해 나가야 할 과제임을 기억해야 합니다. 검사실에서의 검체 품질 평가와 부적합 검체 처리 기준은 이러한 오류를 걸러내고 검사 결과의 신뢰도를 지키기 위한 중요한 안전장치임을 이해하는 것도 중요합니다.
결론적으로, 미생물 검체 채취는 단순한 기술적 절차를 넘어, 정확한 진단과 효과적인 치료의 성패를 좌우하는 과학적이고 분석적인 과정입니다. 검체를 채취하는 의사, 간호사, 임상병리사 등 모든 의료 전문가는 이 과정의 중요성을 깊이 인식하고, 표준 지침에 대한 지속적인 학습과 훈련을 통해 전문성을 함양해야 합니다. 또한, 임상 현장과 검사실 간의 긴밀한 소통과 협력은 오류를 줄이고 최상의 검사 결과를 얻는 데 필수적입니다.
보이지 않는 미생물의 세계를 정확하게 들여다보고 질병과의 싸움에서 승리하기 위한 첫걸음은, 바로 지금 당신의 손에서 이루어지는 '올바른 검체 채취'에 달려있습니다. 이 과정을 정확하고 신중하게 수행하는 것이야말로 환자 중심의 안전하고 효과적인 의료를 실현하는 가장 기본적이면서도 강력한 실천임을 반드시 명심하시기 바랍니다.
2025.04.13 - [인증심사 및 검사실 운영] - 검사실 위험관리 기법 CLSI EP18-A2 (구성요소, 위험사정도구, 위험관리 영역, 인증심사 가이드)
검사실 위험관리 기법 CLSI EP18-A2 (구성요소, 위험사정도구, 위험관리 영역, 인증심사 가이드)
안녕하세요? 여러분은 혹시 병원에서 검사를 받고 그 결과를 기다리면서, '이 검사 결과가 정말 정확할까?' 하는 생각을 해보신 적이 있으신가요? 매일 수많은 검사가 이루어지는 임상 검사실에
labdoctor.tistory.com
2025.04.13 - [분자진단] - FISH (Flourescence in situ hybridization) 의 원리와 방법, 적용 분야
FISH (Flourescence in situ hybridization) 의 원리와 방법, 적용 분야
우리 몸의 세포 하나하나에는 생명의 모든 정보가 담긴 거대한 도서관, 즉 유전체가 존재합니다. 이 도서관에는 수많은 책(염색체)이 있고, 각 책에는 무수히 많은 이야기(유전자)가 적혀 있습니
labdoctor.tistory.com
2025.04.11 - [AI 정보의학 IT] - MCP란 무엇인가? 개념부터 활용까지 완전 정리
MCP란 무엇인가? 개념부터 활용까지 완전 정리
여러분, 요즘 챗GPT나 클로드 같은 거대 언어 모델(LLM) 써보시면 정말 똑똑하다는 생각 드시죠? 그런데 한편으로는 뭔가 답답할 때도 있지 않으셨나요? 예를 들어 "오늘 서울 날씨 어때?"라고 물어
labdoctor.tistory.com
2025.04.08 - [임상화학] - Mass spectrometry의 원리와 임상 검사의 적용
Mass spectrometry의 원리와 임상 검사의 적용
혹시 병원에서 피 한 방울로 수십 가지 질병을 미리 알아내거나, 아주 적은 양의 약물 농도를 정확히 측정하여 환자에게 딱 맞는 치료를 제공하는 장면을 상상해 보신 적 있으신가요? 공상 과학
labdoctor.tistory.com
참고문헌
- Hall, K. K., & Lyman, J. A. (2006). Updated review of blood culture contamination. Clinical microbiology reviews, 19(4), 788–802.
- World Health Organization (WHO). (2021). Antimicrobial resistance. https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance
- Clinical and Laboratory Standards Institute (CLSI). (2007). Principles and Procedures for Blood Cultures; Approved Guideline. CLSI document GP41-A6 (formerly M47-A). Wayne, PA: Clinical and Laboratory Standards Institute. (Note: Newer versions may exist, refer to the latest CLSI guidelines).
- Baron, E. J., Miller, J. M., Weinstein, M. P., Richter, S. S., Gilligan, P. H., Thomson Jr, R. B., ... & Pritt, B. S. (2013). A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2013 recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM). Clinical Infectious Diseases, 57(4), e22-e121.
- Bowler, P. G., Duerden, B. I., & Armstrong, D. G. (2001). Wound microbiology and associated approaches to wound management. Clinical microbiology reviews, 14(2), 244–269.
- Cockerill, F. R., Wilson, J. W., Vetter, E. A., Goodman, K. M., Torgerson, C. A., Harmsen, W. S., ... & Wilson, W. R. (2004). Optimal testing parameters for blood cultures. Clinical Infectious Diseases, 38(12), 1724–1730.
- Miller, J. M., Binnicker, M. J., Campbell, S., Carroll, K. C., Chapin, K. C., Gilligan, P. H., ... & Yao, J. D. (2018). A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2018 update by the Infectious Diseases Society of America and the American Society for Microbiology. Clinical Infectious Diseases, 67(6), e1-e94.
- Raad, I., Hanna, H. A., Alakech, B., Chatzinikolaou, I., Johnson, M. M., & Tarrand, J. (2004). Differential time to positivity: a useful method for diagnosing catheter-related bloodstream infections. Annals of internal medicine, 140(1), 18–25.
- Clinical and Laboratory Standards Institute (CLSI). (2009). Urinalysis; Approved Guideline—Third Edition. CLSI document GP16-A3. Wayne, PA: Clinical and Laboratory Standards Institute. (Note: Newer versions may exist).
- Murray, P. R., & Washington, J. A. (1975). Microscopic and bacteriologic analysis of expectorated sputum. Mayo Clinic Proceedings, 50(6), 339–344.
- Lipsky, B. A., Berendt, A. R., Cornia, P. B., Pile, J. C., Peters, E. J., Armstrong, D. G., ... & Senneville, É. (2012). 2012 Infectious Diseases Society of America clinical practice guideline for the diagnosis and treatment of diabetic foot infections. Clinical infectious diseases, 54(12), e132-e173.
- Tunkel, A. R., Hasbun, R., Bhimraj, A., Byers, K., Kaplan, S. L., Scheld, W. M., ... & Zimmerli, W. (2017). 2017 Infectious Diseases Society of America’s clinical practice guidelines for healthcare-associated ventriculitis and meningitis. Clinical Infectious Diseases, 64(6), e34-e65.
- Garcia, L. S. (Ed.). (2016). Diagnostic medical parasitology (6th ed.). ASM Press.
- Schifman, R. B., Strand, C. L., Meier, F. A., & Howanitz, P. J. (1998). Blood culture contamination: a College of American Pathologists Q-Probes study involving 640 institutions and 497134 specimens from adult patients. Archives of pathology & laboratory medicine, 122(3), 216–221.
- Sharp, S. E. (2001). Specimen collection and transport. In Manual of Clinical Microbiology (8th ed., pp. 45-61). ASM Press.
'임상미생물' 카테고리의 다른 글
| 세균배양검사를 위한 배지의 종류 (0) | 2025.04.17 |
|---|---|
| 미생물 검체의 운송 및 접종 (0) | 2025.04.17 |
| 호기성, 혐기성, 편성 혐기성균이란 (2) | 2025.04.16 |
| 미생물 검사 자동화 배양법 (0) | 2025.04.16 |
| 진단검사실에 사용되는 생물학적 안전 상자의 종류와 기능 (1) | 2025.04.15 |




댓글