병원에 방문하여 감염이 의심될 때, 의사는 종종 "균 배양 검사를 해봅시다"라고 말합니다. 그리고 며칠 뒤에야 검사 결과를 들을 수 있다는 안내를 받게 되지요. 혹시 이런 경험, 있지 않으신가요? 왜 어떤 검사는 금방 결과가 나오는데, 유독 미생물 배양 검사는 이렇게 오랜 시간이 걸리는 걸까요? 심지어 검체 종류에 따라 결과가 나오는 시간도 제각각입니다. 소변 검사는 하루 이틀이면 된다는데, 피검사나 가래 검사는 며칠씩 걸리고, 어떤 경우는 몇 주를 기다려야 한다고도 합니다. 도대체 이 차이는 어디서 오는 걸까요?
이번 시간에는 바로 이 미생물 검체 종류별 배양 기간이라는 흥미로운 주제에 대해 깊이 있게 파헤쳐 보고자 합니다. 우리는 먼저 눈에 보이지 않는 작은 생명체, 미생물을 '키우는' 과정인 미생물 배양이 무엇인지, 그 기본적인 원리부터 차근차근 알아볼 것입니다.
미생물 배양, 보이지 않는 세계를 들여다보는 창
미생물 배양이란 과연 무엇일까요? 아마 많은 분들이 '균을 키운다' 정도로 막연하게 생각하실 수 있습니다. 맞습니다. 미생물 배양은 기본적으로 눈에 보이지 않을 정도로 작은 미생물을 실험실 환경에서 인위적으로 증식시키는 과정을 의미합니다. 하지만 단순히 '키운다'는 표현만으로는 그 중요성과 복잡성을 다 담아내기 어렵습니다. 미생물 배양은 감염병 진단뿐만 아니라 식품 위생 검사, 신약 개발, 환경 정화 등 다양한 과학 및 산업 분야에서 없어서는 안 될 핵심적인 기술이기 때문이지요.
그렇다면 왜 우리는 미생물을 직접 관찰하지 않고 굳이 시간과 노력을 들여 배양해야 할까요? 그 이유는 크게 두 가지로 설명할 수 있습니다. 첫째, 감염 부위에 존재하는 원인 미생물의 수가 매우 적을 수 있기 때문입니다. 예를 들어 패혈증 초기 단계의 환자 혈액 1mL 속에는 세균이 단 몇 마리만 존재할 수도 있습니다. 이처럼 적은 수의 미생물은 현미경으로 직접 관찰하거나 다른 방법으로 검출하기가 극도로 어렵습니다. 따라서 배양을 통해 미생물의 수를 수백만, 수억 배로 증폭시켜야만 우리가 그 존재를 확인하고 정체를 밝혀낼 수 있는 것이지요. 이는 마치 아주 작은 단서 하나를 가지고 범인을 찾아야 할 때, 그 단서를 확대하고 분석하여 결정적인 증거를 만드는 과정과 유사하다고 할 수 있습니다.
둘째, 미생물의 정확한 종류를 파악하기 위해서입니다. 우리 주변과 몸속에는 수많은 종류의 미생물이 존재합니다. 감염을 일으킨 원인균을 정확히 알아야 그에 맞는 효과적인 항생제를 선택하여 치료할 수 있습니다. 하지만 대부분의 미생물은 형태만으로는 종류를 구분하기 어렵습니다. 배양을 통해 충분한 수의 미생물 집락(colony, 콜로니)을 얻으면, 이 집락의 모양, 색깔, 냄새 등을 관찰하고 다양한 생화학적 검사나 유전자 검사를 수행하여 미생물의 종류, 즉 '이름'을 정확하게 밝혀낼 수 있습니다. 마치 여러 종류의 씨앗을 심어 싹이 트고 자라난 모습을 보고 어떤 식물인지 구별하는 것과 같다고 생각할 수 있습니다.
이러한 미생물 배양 과정을 성공적으로 수행하기 위해서는 두 가지 핵심 요소가 반드시 필요합니다. 바로 '배지(medium)'와 '적절한 배양 환경'입니다. 배지는 미생물이 살아가는 데 필요한 영양분을 공급하는 역할을 합니다. 사람에게 밥과 반찬이 필요하듯, 미생물도 탄소원, 질소원, 무기염류, 비타민 등 다양한 영양소가 필요하지요. 이 배지는 크게 액체 상태의 액체 배지와 한천(agar)이라는 젤리 같은 성분을 첨가하여 굳힌 고체 배지로 나눌 수 있습니다. 액체 배지는 주로 미생물을 대량으로 증식시킬 때 사용하고, 고체 배지는 미생물 집락을 시각적으로 관찰하고 순수하게 분리하는 데 사용됩니다.
배지는 그 목적에 따라 더욱 다양하게 분류될 수 있습니다. 예를 들어, 대부분의 미생물이 잘 자랄 수 있도록 기본적인 영양소를 풍부하게 함유한 기본 배지(예: Nutrient agar), 특정 미생물의 성장을 촉진하거나 다른 미생물의 성장을 억제하는 성분을 첨가한 선택 배지(예: MacConkey agar - 그람 음성균 선택), 특정 미생물이 자라면서 나타내는 생화학적 반응을 통해 다른 미생물과 구별할 수 있도록 만든 감별 배지(예: Blood agar - 용혈성 확인) 등이 있습니다. 마치 특정 식물만 잘 자라도록 토양의 성분을 조절하거나, 식물이 자라면서 토양 색깔이 변하게 만들어 종류를 구별하는 것과 유사하다고 할 수 있겠네요.
다음으로 중요한 것은 바로 '적절한 배양 환경'입니다. 미생물도 생명체이기에, 자신이 가장 잘 자랄 수 있는 환경 조건이 있습니다. 가장 대표적인 것이 온도입니다. 사람의 체온과 비슷한 35~37°C에서 잘 자라는 미생물(중온균)이 있는가 하면, 더 낮은 온도나 높은 온도에서 잘 자라는 미생물도 있습니다. 또한, 산소의 필요 유무도 매우 중요합니다. 산소가 있어야만 살 수 있는 호기성 세균, 산소가 있으면 오히려 죽거나 성장이 억제되는 혐기성 세균, 산소가 있든 없든 잘 자라는 통성 혐기성 세균 등이 있지요. 이 외에도 습도나 pH(산성도) 등도 미생물 성장에 영향을 미치는 중요한 환경 요인입니다. 따라서 실험실에서는 배양하려는 미생물의 종류에 맞춰 최적의 온도, 산소 농도, 습도 등을 정밀하게 제어하는 배양기(incubator)를 사용합니다.
정리하자면, 미생물 배양은 검체 속 미생물에게 최적의 영양분(배지)과 환경 조건을 제공하여 충분히 증식시킨 후, 그 존재를 확인하고 종류를 밝혀내는 일련의 과정이라고 할 수 있습니다. 이 과정은 감염병의 정확한 진단과 효과적인 치료를 위한 필수적인 단계이며, 배지 선택과 배양 환경 조절이라는 과학적 원리에 기반하고 있습니다. 이제 미생물 배양의 기본 개념을 이해하셨으니, 다음으로는 미생물이 실제로 어떻게 증식하는지, 그 성장 패턴에 대해 더 자세히 알아보겠습니다. 이것이 바로 배양 기간을 결정하는 핵심 열쇠이기 때문입니다.
미생물은 어떻게 자라날까? - 성장 곡선의 비밀
ㅊ

미생물이 배지에 접종되어 적절한 환경에서 배양되기 시작하면, 과연 어떤 과정을 거쳐 증식하게 될까요? 마치 갓 태어난 아기가 성장하여 어른이 되듯, 미생물 집단도 시간이 지남에 따라 일정한 패턴을 그리며 그 수가 변화합니다. 이러한 미생물 집단의 시간 경과에 따른 개체 수 변화를 그래프로 나타낸 것을 바로 '미생물 성장 곡선(Microbial Growth Curve)'이라고 부르며, 이는 미생물 배양 기간을 이해하는 데 있어 매우 중요한 개념입니다. 이 성장 곡선은 일반적으로 네 개의 뚜렷한 단계로 구분되는데요, 각 단계의 특징과 의미를 자세히 살펴보겠습니다.
첫 번째 단계는 '유도기(Lag Phase)'입니다. 이는 미생물이 새로운 환경, 즉 배지에 처음 접종된 후 즉시 왕성하게 분열하지 않고 주변 환경에 적응하는 시기를 말합니다. 마치 새로운 학교에 전학 온 학생이 처음에는 낯선 환경에 적응하며 주변을 탐색하는 시간과 비슷하다고 할 수 있습니다. 이 단계에서는 미생물 세포의 크기가 커지고 대사 활동이 활발해지지만, 세포 분열은 거의 일어나지 않아 개체 수는 크게 증가하지 않습니다. 유도기의 길이는 미생물의 종류, 접종된 미생물의 상태(이전 환경에서의 영양 상태 등), 그리고 새로운 배지의 조건에 따라 달라질 수 있습니다.
두 번째 단계는 '대수기(Log Phase 또는 Exponential Phase)'입니다. 유도기를 거쳐 새로운 환경에 완전히 적응한 미생물은 이제 폭발적인 속도로 분열하기 시작합니다. 이 시기에는 미생물 수가 기하급수적으로 증가하며, 일정한 시간 간격으로 개체 수가 두 배씩 늘어나는 특징을 보입니다. 그래프 상에서는 개체 수의 로그(log) 값이 시간에 따라 직선적으로 증가하는 형태로 나타나기 때문에 '대수기'라는 이름이 붙었습니다. 미생물은 이 대수기에 가장 활발하고 건강한 상태를 유지합니다. 마치 청소년기처럼 왕성한 성장과 활동을 보이는 시기라고 비유할 수 있겠네요.
여기서 중요한 개념이 바로 '세대 시간(Generation Time 또는 Doubling Time)'입니다. 세대 시간이란 미생물 한 세대가 분열하여 그 수가 두 배로 증가하는 데 걸리는 평균 시간을 의미합니다. 이 세대 시간은 미생물의 종류와 배양 조건에 따라 크게 달라지는데, 예를 들어 대장균(E. coli)과 같은 일부 세균은 최적 조건에서 세대 시간이 20분 정도로 매우 짧은 반면, 결핵균(Mycobacterium tuberculosis)은 세대 시간이 12~24시간으로 극도로 깁니다. **
바로 이 세대 시간의 차이가 미생물마다 배양 기간이 달라지는 가장 근본적인 이유 중 하나가 되는 것입니다.** 세대 시간이 짧을수록 더 빨리 많은 수로 증식하여 검출 및 동정이 가능해지므로 배양 기간이 짧아지고, 세대 시간이 길수록 충분한 수로 자라는 데 오랜 시간이 걸리므로 배양 기간이 길어질 수밖에 없습니다.
세 번째 단계는 '정지기(Stationary Phase)'입니다. 미생물이 계속해서 폭발적으로 증식할 수는 없습니다. 시간이 지남에 따라 배지 속 영양분은 고갈되고, 미생물의 대사 활동 결과로 생성된 노폐물(독성 물질)은 축적되며, 개체 수가 너무 많아져 공간이 부족해지는 등 성장을 저해하는 요인들이 발생하게 됩니다.
결국 미생물의 증식 속도와 사멸 속도가 거의 같아져 전체적인 개체 수에는 큰 변화가 없는 상태에 도달하는데, 이 시기를 정지기라고 합니다. 그래프 상에서는 성장 곡선이 수평을 이루는 형태로 나타납니다. 이는 마치 자원이 한정된 환경에서 인구가 더 이상 늘지 않고 정체되는 현상과 유사합니다. 미생물 배양 검사에서는 일반적으로 대수기 후반이나 정지기 초반에 충분한 수의 미생물이 형성되어 육안으로 집락을 관찰하거나 다음 단계의 검사를 진행할 수 있게 됩니다.
마지막 네 번째 단계는 '사멸기(Death Phase 또는 Decline Phase)'입니다. 정지기 상태가 지속되면 영양분 고갈과 독성 노폐물 축적이 더욱 심화되어, 결국 미생물의 사멸 속도가 증식 속도를 앞지르게 됩니다. 이에 따라 살아있는 미생물의 수는 점차 감소하게 되는데, 이 시기를 사멸기라고 합니다. 그래프 상에서는 곡선이 하강하는 형태로 나타납니다. 물론 모든 미생물이 동시에 죽는 것은 아니며, 일부는 휴면 상태(spore 형성 등)로 전환하여 생존하기도 합니다.
자, 이렇게 미생물은 유도기 → 대수기 → 정지기 → 사멸기라는 특징적인 성장 곡선을 그리며 증식합니다. 미생물 배양의 목표는 주로 대수기 후반이나 정지기 초반에 도달하여 충분한 양의 미생물을 얻는 것이며, 이때까지 걸리는 시간이 바로 '배양 기간'의 기준이 되는 것입니다. 그리고 앞서 강조했듯이, 미생물 종류별 세대 시간의 차이가 이 배양 기간을 결정하는 매우 중요한 요소임을 반드시 기억해야 합니다. 그렇다면 도대체 왜 미생물마다 이렇게 자라는 속도가 다른 걸까요? 다음 섹션에서 그 이유를 좀 더 깊이 파헤쳐 보겠습니다.
왜 미생물마다 자라는 속도가 다를까?
우리는 앞서 미생물의 성장 곡선과 세대 시간 개념을 통해 미생물마다 증식 속도가 다르다는 사실을 확인했습니다. 대장균처럼 순식간에 불어나는 녀석이 있는가 하면, 결핵균처럼 아주 오랜 시간을 들여야 겨우 자라는 녀석도 있지요. 이러한 성장 속도의 차이는 대체 어디에서 비롯되는 걸까요? 그 이유는 단순히 한 가지로 설명될 수 없으며, 미생물의 종류, 유전적 특성, 대사 방식, 그리고 주변 환경과의 상호작용 등 다양한 요인들이 복합적으로 작용한 결과입니다.
가장 큰 차이는 미생물의 기본적인 분류, 즉 세균(Bacteria)과 진균(Fungi, 곰팡이나 효모 등) 사이에서 나타납니다. 일반적으로 진균은 세균보다 훨씬 느리게 자랍니다. 왜 그럴까요? 이는 세포 구조의 복잡성 차이에서 기인하는 바가 큽니다. 세균은 비교적 단순한 구조의 원핵세포(prokaryotic cell)로, 핵막이 없고 세포 내 소기관도 단순합니다.
반면 진균은 사람의 세포와 같이 핵막으로 둘러싸인 핵과 다양한 세포 소기관을 가진 진핵세포(eukaryotic cell)입니다. 세포 구조가 더 복잡하다는 것은 세포 분열 과정 역시 더 복잡하고 많은 단계를 거쳐야 함을 의미하며, 이는 자연스럽게 더 긴 세대 시간으로 이어집니다. 또한, 대사 과정이나 영양분 흡수 방식 등에서도 차이가 있어 진균의 전반적인 성장 속도가 세균보다 느린 경향을 보이는 것입니다. 이것이 바로 진균 감염 검사 시 배양 기간이 세균성 감염 검사보다 훨씬 길게(수 주 이상) 소요되는 주된 이유입니다.
세균 내에서도 성장 속도는 천차만별입니다. 앞서 예시로 들었던 대장균(E. coli)은 최적 조건에서 20분마다 분열하는, 그야말로 '속도광'입니다. 이런 빠른 성장 속도는 대장균이 비교적 단순한 영양분만으로도 필요한 모든 구성 성분을 효율적으로 합성해내는 능력을 갖추고 있기 때문에 가능합니다. 반면, 결핵균(Mycobacterium tuberculosis)은 세대 시간이 12시간 이상으로 극도로 느립니다.
결핵균의 세포벽은 미콜산(mycolic acid)이라는 복잡하고 두꺼운 지질 성분으로 이루어져 있는데, 이 특수한 세포벽을 합성하는 데 많은 시간과 에너지가 소모됩니다. 또한, 결핵균은 생존에 필요한 특정 영양소 요구 조건이 까다롭고 전반적인 대사 속도가 느리기 때문에 성장이 매우 더딜 수밖에 없습니다. 이처럼 각 세균이 가진 고유한 유전적 특성과 그에 따른 세포 구조(특히 세포벽), 대사 경로의 효율성 등이 성장 속도 차이를 유발하는 핵심적인 요인이라고 할 수 있습니다.
미생물이 필요로 하는 환경 조건 역시 성장 속도에 결정적인 영향을 미칩니다. 특히 산소 요구성은 중요한 요인 중 하나입니다. 산소를 반드시 필요로 하는 절대 호기성 세균(obligate aerobe), 산소가 없는 환경에서만 살 수 있는 절대 혐기성 세균(obligate anaerobe), 산소 유무에 상관없이 자랄 수 있는 통성 혐기성 세균(facultative anaerobe), 약간의 산소가 있는 환경을 선호하는 미호기성 세균(microaerophile) 등 미생물마다 산소에 대한 반응이 다릅니다.
실험실에서 배양할 때는 각 미생물의 산소 요구성에 맞는 환경을 조성해주어야 최적의 성장을 유도할 수 있습니다. 예를 들어, 혐기성 세균은 산소가 완벽히 제거된 특수 배양 시스템이 필요하며, 이러한 조건을 맞추는 과정과 혐기성 세균 자체의 느린 성장 특성 때문에 일반적인 세균 배양보다 시간이 더 소요되는 경우가 많습니다.
온도 또한 빼놓을 수 없는 중요한 환경 요인입니다. 대부분의 인체 병원성 세균은 사람의 체온과 유사한 35-37°C에서 가장 잘 자라는 중온균(mesophile)이지만, 어떤 미생물은 이보다 낮은 온도(저온균, psychrophile)나 높은 온도(고온균, thermophile)를 선호하기도 합니다. 만약 배양 온도가 해당 미생물의 최적 성장 온도에서 벗어난다면, 효소 활성이 저하되고 대사 속도가 느려져 성장 속도가 현저히 떨어지게 됩니다. 따라서 정확한 배양 온도 설정은 신속하고 효율적인 미생물 증식에 필수적입니다.
마지막으로, 영양 요구도 역시 성장 속도에 영향을 미칩니다. 어떤 미생물들은 생존에 필요한 아미노산, 비타민, 핵산 등을 스스로 합성하지 못하고 반드시 외부 환경(배지)으로부터 공급받아야 합니다. 이렇게 특별한 영양소를 요구하는 미생물을 '까다로운 미생물(fastidious organism)'이라고 부릅니다. 예를 들어, 헤모필루스 인플루엔자(Haemophilus influenzae)는 혈액 내에 존재하는 X 인자(헤민)와 V 인자(NAD)가 모두 있어야만 자랄 수 있습니다. 이러한 까다로운 미생물들은 일반적인 배지에서는 잘 자라지 못하거나 매우 느리게 자라므로, 특정 영양소가 강화된 특수 배지를 사용해야 하며, 배양 기간이 더 길어질 수 있습니다.
결론적으로, 미생물마다 성장 속도가 다른 이유는 세균/진균과 같은 근본적인 분류 차이, 각 미생물이 가진 고유한 유전적 특성과 세포 구조, 대사 방식의 효율성, 그리고 산소, 온도, 영양분 등 주변 환경 조건에 대한 요구도와 적응 능력의 차이 때문이라고 정리할 수 있습니다. 이러한 요인들이 복합적으로 작용하여 각 미생물의 고유한 '세대 시간'을 결정하고, 이는 결국 우리가 경험하는 검체 종류별 배양 기간의 차이로 나타나는 것입니다. 자, 이제 이러한 기본 지식을 바탕으로 실제 임상 검사실에서 다루는 다양한 검체들의 배양 기간이 왜 다른지, 구체적인 사례들을 통해 본격적으로 탐구해볼 시간입니다.
혈액 배양: 시간과의 싸움, 패혈증 진단의 핵심
병원에서 시행되는 미생물 검사 중 가장 긴급하고 중요한 검사 중 하나를 꼽으라면 단연 혈액 배양(Blood Culture)일 것입니다. 왜냐하면 혈액 배양은 생명을 위협할 수 있는 심각한 상태인 패혈증(Sepsis)을 진단하는 데 결정적인 역할을 하기 때문입니다. 패혈증은 미생물 감염에 대한 우리 몸의 과도한 면역 반응으로 인해 주요 장기의 기능 부전이 발생하는 치명적인 질환으로, 시간당 사망률이 급격히 증가하기 때문에 최대한 빠른 진단과 적절한 항생제 치료가 환자의 생존에 직결됩니다 [1].
아니, 그렇게 위급하다면서 왜 혈액 배양은 결과를 보는 데 5일이나 걸린다는 거야? 당장 내일이라도 결과를 알려줘야 하는 거 아니야?
정말 좋은 질문입니다. 패혈증의 위급성을 생각하면 하루빨리 결과를 알고 싶은 마음이 드는 것은 당연합니다. 하지만 혈액 배양에 비교적 긴 시간이 소요되는 데에는 그럴 만한 이유가 있습니다. 가장 중요한 이유는 혈액 내에 존재하는 미생물의 수가 매우 적을 수 있다는 점입니다. 혈액은 원래 건강한 상태에서는 미생물이 전혀 존재하지 않는 무균 상태(sterile)여야 합니다. 만약 혈액 속에서 세균이나 진균이 발견된다면(이를 각각 균혈증(bacteremia), 진균혈증(fungemia)이라고 합니다), 이는 심각한 감염이 진행되고 있음을 시사하는 강력한 증거입니다.
하지만 감염 초기나 간헐적으로 균이 혈류로 유입되는 경우, 환자의 혈액 1mL당 존재하는 미생물의 수는 단 몇 개에서 수십 개에 불과할 정도로 매우 적을 수 있습니다 [2]. 심지어 성인보다 소아 환자에서 균 수가 더 높은 경향이 있지만, 여전히 낮은 농도인 경우가 많습니다. 이렇게 극소량으로 존재하는 미생물을 직접 검출하는 것은 거의 불가능에 가깝습니다.
따라서 혈액 배양의 핵심 목적은 바로 이 소수의 미생물을 눈에 보일 정도로, 그리고 다음 단계의 동정 검사 및 항생제 감수성 검사를 수행할 수 있을 정도로 충분히 증폭시키는 데 있습니다. 마치 넓은 사막에서 바늘 하나를 찾는 대신, 그 바늘 주변에 자석을 놓아 수많은 쇠붙이를 끌어모아 바늘의 존재를 확인하는 것과 비슷하다고 할 수 있습니다.

이러한 증폭 과정을 위해 혈액 검체는 특수하게 제작된 '혈액 배양 병(blood culture bottle)'에 접종됩니다. 이 병 안에는 미생물이 자라는 데 필요한 각종 영양분이 풍부하게 들어있는 액체 배지가 담겨 있으며, 환자의 혈액 응고를 막는 항응고제와 환자가 이미 투여받고 있을 수 있는 항생제의 효과를 중화시키는 물질(예: 흡착 수지)이 첨가되어 있기도 합니다. 일반적으로 산소가 필요한 호기성 미생물용 병과 산소가 없는 환경을 선호하는 혐기성 미생물용 병, 두 종류를 한 세트로 채혈하여 배양하는 것이 표준적인 방법입니다.
채혈된 혈액이 담긴 배양 병은 자동 혈액 배양 시스템(automated blood culture system)이라는 첨단 장비에 즉시 장착됩니다. 이 장비는 배양 병을 최적의 온도(보통 35-37°C)로 유지하면서 주기적으로 흔들어주어 미생물 성장과 배지 내 산소 공급을 촉진합니다. 그리고 가장 중요한 기능은 미생물이 자라면서 배출하는 이산화탄소(CO2)나 기타 가스의 증가, 또는 배지의 혼탁도 변화 등을 실시간으로 감지하는 것입니다.
미생물이 증식하면 대사 활동의 결과로 CO2가 발생하는데, 배양 병 바닥에 있는 센서가 이 CO2 농도 변화를 감지하여 미생물 성장을 포착하는 원리입니다. 만약 시스템이 미생물 성장을 감지하면(즉, '양성 신호'가 뜨면), 즉시 경보음을 울려 검사실 직원에게 알립니다.
그렇다면 왜 표준 배양 기간이 5일일까요? 대부분의 흔한 패혈증 원인균, 예를 들어 황색포도알균(Staphylococcus aureus), 대장균(E. coli), 폐렴알균(Streptococcus pneumoniae) 등은 성장 속도가 비교적 빨라서 자동 혈액 배양 시스템에서 24시간에서 48시간 이내에 양성 신호를 보이는 경우가 많습니다 [3].
따라서 양성 신호가 뜨면 검사실에서는 즉시 해당 병을 꺼내 그람 염색(Gram stain)을 실시하여 세균의 형태(알균/막대균)와 그람 염색성(양성/음성)을 확인하고, 이 정보를 신속하게 의사에게 중간 보고합니다. 이 중간 보고만으로도 의사는 경험적 항생제 치료를 시작하거나 조정하는 데 큰 도움을 받을 수 있습니다.
하지만 문제는 모든 미생물이 이렇게 빨리 자라지는 않는다는 점입니다. 일부 세균, 예를 들어 브루셀라(Brucella)균이나 특정 영양 요구성이 까다로운 세균(fastidious bacteria), 그리고 칸디다(Candida)와 같은 진균 등은 성장 속도가 매우 느려서 양성 신호가 나타나기까지 3일 이상, 심지어 5일까지 걸릴 수도 있습니다.
또한, 환자가 항생제 치료를 받고 있는 상태에서 채혈된 경우, 항생제의 영향으로 미생물이 일시적으로 성장이 억제되었다가 서서히 회복하면서 늦게 자랄 수도 있습니다. 따라서 5일이라는 배양 기간은 이러한 느리게 자라는 잠재적 병원균이나 항생제 영향으로 성장이 지연된 균을 놓치지 않고 검출하기 위한, 일종의 '안전 기간'이라고 할 수 있습니다. 임상미생물학 분야의 국제 표준 가이드라인인 CLSI(Clinical and Laboratory Standards Institute)에서도 대부분의 임상적으로 유의한 균혈증/진균혈증은 5일 이내에 검출된다는 근거에 기반하여 표준 배양 기간을 권고하고 있습니다 [4]. 만약 5일 동안 배양해도 아무런 성장 신호가 없다면, 최종적으로 '음성(균 배양 안 됨)'으로 보고하게 됩니다.
물론, 양성 신호가 떴다고 해서 바로 최종 결과가 나오는 것은 아닙니다. 양성 신호 후에는 해당 배양액을 다시 고체 배지에 접종하여 순수하게 분리 배양하고, 완전히 자라난 집락을 이용하여 정확한 균 동정 검사(어떤 종류의 균인지 밝히는 검사)와 항생제 감수성 검사(어떤 항생제가 효과가 있는지 알아보는 검사)를 추가로 진행해야 합니다. 이 과정에 보통 1~2일 정도의 시간이 더 소요됩니다. 따라서 혈액 배양 검사는 양성 신호까지의 시간 + 추가 동정/감수성 검사 시간을 합쳐 최종 결과 보고까지 며칠이 걸리게 되는 것입니다.
혈액 배양 결과에 영향을 미치는 다른 요인들도 고려해야 합니다. 충분한 양의 혈액을 채취하는 것(성인 기준 병당 8-10mL 권장)은 검출률을 높이는 데 매우 중요하며, 열이 나기 시작하는 시점 등 적절한 타이밍에 채혈하는 것도 중요합니다. 또한, 채혈 과정에서 피부 소독을 철저히 하지 않으면 피부에 정상적으로 존재하는 상재균(예: Coagulase-negative staphylococci, CNS)이 혼입되어 배양될 수 있는데, 이를 실제 균혈증과 감별하는 것이 중요합니다. 오염으로 인한 위양성 결과는 불필요한 항생제 사용과 입원 기간 연장을 초래할 수 있기 때문입니다 [5].
정리하자면, 혈액 배양은 패혈증 진단의 핵심적인 검사로, 혈액 내 극소량으로 존재할 수 있는 미생물을 증폭시켜 검출하는 것이 목적입니다. 자동 혈액 배양 시스템을 이용하여 실시간 모니터링하지만, 느리게 자라는 균이나 항생제 영향을 고려하여 표준적으로 5일간 배양합니다. 비록 시간이 다소 소요되지만, 정확한 원인균 동정과 항생제 감수성 결과는 패혈증 환자의 생명을 구하는 데 결정적인 정보를 제공하므로, 그 기다림은 매우 중요하고 의미있는 과정이라고 할 수 있습니다. 이제 다음으로는 우리에게 좀 더 친숙한 검사인 소변 배양에 대해 알아보겠습니다. 소변 배양은 왜 혈액 배양보다 훨씬 빨리 결과가 나올까요?
소변 배양: 요로 감염의 흔적을 찾아서
소변 배양(Urine Culture)은 아마도 많은 분들이 한 번쯤 경험해 보셨을 법한 비교적 흔한 미생물 검사일 것입니다. 주로 방광염이나 신우신염과 같은 요로 감염(Urinary Tract Infection, UTI)이 의심될 때 시행됩니다. 요로 감염은 특히 여성에게 흔하게 발생하는 감염 질환 중 하나이지요. 다행히도 소변 배양 검사는 앞서 살펴본 혈액 배양에 비해 결과를 확인하기까지 걸리는 시간이 훨씬 짧은 편입니다. 보통 검체를 접수한 다음 날이면 예비 결과를 알 수 있는 경우가 많습니다. 왜 이렇게 차이가 나는 걸까요?
가장 큰 이유는 소변 검체와 혈액 검체의 근본적인 특성 차이에 있습니다. 혈액은 원래 무균 상태여야 하지만, 요로는 외부와 연결되어 있어 약간의 세균이 존재할 수 있습니다. 물론 정상적인 방광 내 소변은 무균 상태에 가깝지만, 소변이 배출되는 통로인 요도에는 다양한 종류의 정상 세균총(normal flora)이 살고 있습니다. 따라서 소변을 채취하는 과정에서 이러한 요도 상재균이나 피부 세균에 의해 검체가 오염될 가능성이 혈액보다 훨씬 높습니다.

하지만 동시에, 실제 요로 감염이 발생한 경우에는 소변 내 원인균의 수가 혈액 내 균 수보다 훨씬 많은 경향이 있습니다. 방광이나 신장에서 염증을 일으키는 세균은 소변이라는 '배지' 안에서 비교적 쉽게 증식할 수 있기 때문입니다. 요로 감염의 가장 흔한 원인균인 대장균(E. coli) 같은 장내세균들은 영양분이 풍부한 환경에서 매우 빠르게 자라는 특징을 가지고 있습니다. 따라서 요로 감염 환자의 소변 1mL 속에는 10만 개(10^5 CFU/mL) 이상의 세균이 존재하는 경우가 흔합니다 [6]. 혈액 배양에서 1mL당 몇 개의 균을 증폭시켜야 했던 것과는 상황이 완전히 다른 것이지요.
이러한 특성 때문에 소변 배양의 주된 목적은 단순히 균의 존재 유무를 확인하는 것이 아니라, '의미 있는 양'의 세균이 존재하는지, 즉 '유의미한 세균뇨(significant bacteriuria)'를 확인하는 데 있습니다. 소량의 균이 검출되더라도 이는 채취 과정에서의 오염일 가능성이 높기 때문에, 일정 기준치 이상의 균 수를 확인하는 것이 중요합니다. 이를 위해 소변 배양에서는 '정량 배양(quantitative culture)'이라는 방법을 사용합니다. 이는 정해진 양의 소변(보통 0.001mL 또는 0.01mL)을 담을 수 있는 작은 고리 모양의 도구인 백금이(calibrated loop)를 사용하여 소변을 고체 배지에 정확하게 접종하는 방식입니다.
접종된 배지는 보통 혈액 한천 배지(Blood agar)와 MacConkey 한천 배지와 같은 감별 배지에 동시에 이루어집니다. 혈액 한천 배지는 대부분의 세균이 잘 자랄 수 있게 하면서 용혈성(적혈구를 파괴하는 능력) 유무를 확인할 수 있고, MacConkey 한천 배지는 그람 음성균만 선택적으로 자라게 하면서 유당(lactose) 분해 능력에 따라 집락 색깔이 달라져 대장균과 같은 유당 분해균을 쉽게 감별할 수 있도록 도와줍니다.
이제 가장 중요한 배양 기간에 대해 이야기해 보겠습니다. 소변 검체가 접종된 배지는 일반적으로 35-37°C 배양기에서 18시간에서 24시간 동안 배양한 후 첫 판독을 실시합니다. 왜 하룻밤이면 충분할까요? 앞서 언급했듯이, 요로 감염의 주된 원인균인 대장균을 포함한 대부분의 장내세균들은 세대 시간이 매우 짧아(20-30분) 하룻밤(18-24시간)이면 육안으로 충분히 관찰 가능한 크기의 집락(colony)을 형성하기 때문입니다. 마치 씨앗을 뿌렸는데 다음날 아침에 벌써 싹이 돋아난 것을 확인하는 것과 비슷하다고 할 수 있습니다.
24시간 판독 시, 배지 위에 자라난 세균 집락의 수를 세어 원래 소변 1mL당 몇 개의 균이 있었는지(CFU/mL, Colony Forming Units per milliliter)를 계산합니다. 예를 들어, 0.001mL 백금이를 사용했는데 100개의 집락이 관찰되었다면, 이는 100 CFU / 0.001mL = 100,000 CFU/mL, 즉 10^5 CFU/mL의 세균이 존재한다는 의미입니다. 일반적으로 10^5 CFU/mL 이상이면 유의미한 세균뇨로 판정하고 요로 감염을 강력히 시사하는 소견으로 해석합니다 [6]. 물론, 환자의 증상, 소변 채취 방법(중간뇨, 도뇨관 소변 등), 검출된 균의 종류 등을 종합적으로 고려하여 최종 진단을 내리게 됩니다.
그렇다면 24시간 배양 후 균이 자라지 않았거나 아주 소량만 자랐다면 어떻게 할까요? 대부분의 경우 추가 배양 없이 '음성' 또는 '오염 가능성'으로 보고될 수 있습니다. 하지만 임상적으로 요로 감염이 강력히 의심되거나, 항생제를 이미 사용 중인 환자이거나, 또는 특정 균(예: 효모(Yeast)나 일부 까다로운 세균) 감염이 의심되는 경우에는 배양 기간을 48시간까지 연장하여 관찰하기도 합니다. 일부 느리게 자라는 균이나 항생제에 의해 성장이 억제된 균이 늦게 나타날 가능성을 고려하는 것이지요. 그러나 일반적인 요로 감염 진단에서는 24시간 배양으로 충분한 경우가 대부분입니다.
결과적으로 소변 배양은 혈액 배양에 비해 상대적으로 균 수가 많고, 주 원인균의 성장 속도가 빠르며, 정량 배양을 통해 유의미한 균 수 확인이 중요하기 때문에, 표준 배양 기간이 18-24시간으로 짧은 편입니다. 물론, 24시간 판독 후에도 균 동정 및 항생제 감수성 검사를 위해서는 추가적인 시간(보통 1일)이 더 필요하지만, 초기 결과 확인까지의 시간은 훨씬 단축되는 장점이 있습니다.
여기서 한 가지 주의할 점은 소변 검체의 '질'입니다. 앞서 언급했듯이 소변은 오염되기 쉽기 때문에, 올바른 방법으로 소변을 채취하는 것이 매우 중요합니다. 보통 '중간뇨(midstream clean-catch urine)'를 받는 것이 권장되는데, 이는 처음 나오는 소변을 약간 버리고 중간 부분의 소변을 소독된 용기에 받는 방법입니다. 이렇게 하면 요도 입구 주변의 오염을 최소화하여 검사 결과의 정확도를 높일 수 있습니다. 부적절하게 채취된 소변은 여러 종류의 균이 섞여 자라거나 실제 원인균이 아닌 오염균만 검출되어 진단에 혼란을 줄 수 있습니다.
요약하면, 소변 배양은 요로 감염 진단을 위해 시행되며, 비교적 많은 수의 원인균이 빠르게 증식하는 특성 덕분에 일반적으로 18-24시간 배양 후 판독이 가능합니다. 정량 배양을 통해 유의미한 세균뇨를 확인하는 것이 중요하며, 검체 오염을 최소화하는 것이 정확한 결과를 위해 필수적입니다. 이제 다음으로는 좀 더 복잡한 상황을 마주하게 되는 호흡기 검체 배양에 대해 알아보도록 하겠습니다. 호흡기 검체는 왜 배양 기간이 더 길고 까다로울까요?
객담 및 호흡기 검체 배양: 숨어있는 병원균을 찾아서
기침이 심하고 누런 가래가 나오거나 숨쉬기 힘들 때, 우리는 폐렴이나 기관지염 같은 호흡기 감염을 의심하게 됩니다. 이러한 경우 의사는 원인균을 밝혀내기 위해 객담(Sputum, 가래)이나 기관지 폐포 세척액(Bronchoalveolar lavage, BAL)과 같은 호흡기 검체를 채취하여 미생물 배양 검사를 의뢰하게 됩니다. 그런데 호흡기 검체 배양은 앞서 살펴본 혈액이나 소변 배양과는 또 다른 어려움과 복잡성을 가지고 있으며, 배양 기간 또한 달라지는 경우가 많습니다. 과연 어떤 점들이 다를까요?
가장 큰 특징이자 어려움은 바로 호흡기 검체, 특히 객담에 원래부터 살고 있는 수많은 '정상 세균총(Normal Flora)'의 존재입니다. 우리의 입안, 코, 목구멍 등 상기도에는 다양한 종류의 세균들이 평화롭게 공존하며 살아가고 있습니다. 이들은 대부분 병을 일으키지 않는 공생균이지만, 객담은 폐 깊숙한 곳에서부터 배출되는 과정에서 이러한 상기도를 거쳐 나오기 때문에 정상 세균총에 의한 오염이 매우 심각할 수밖에 없습니다. 마치 깨끗한 물을 길어오려는데, 물통을 가져오는 길목이 온통 흙탕물인 상황과 비슷하다고 할 수 있습니다.
따라서 객담 검체를 받으면 가장 먼저 하는 일 중 하나가 바로 '검체의 질 평가(Quality Assessment)'입니다. 현미경으로 객담 도말 표본을 관찰하여 백혈구(염증 세포)와 편평 상피 세포(구강 유래 세포)의 비율을 확인하는 것입니다. 백혈구가 많고 상피 세포가 적을수록 폐 깊은 곳에서 유래한 '좋은' 검체로 판단하고, 반대로 상피 세포가 많고 백혈구가 적으면 침(saliva)에 가까운 '부적절한' 검체로 판단하여 배양 결과의 신뢰도를 평가합니다 [7]. 부적절한 검체에서는 실제 폐렴 원인균보다 구강 내 정상 세균총만 잔뜩 배양될 가능성이 높기 때문입니다.

이러한 정상 세균총의 존재는 배양 과정에도 영향을 미칩니다. 배양의 목표는 이 수많은 정상 세균총 속에서 실제 감염을 일으키는 '병원성 미생물(pathogen)'을 찾아내어 분리하고 동정하는 것입니다. 이를 위해 검사실에서는 다양한 종류의 배지를 함께 사용합니다. 대부분의 세균이 자랄 수 있는 비선택 배지(예: 혈액 한천 배지)와 함께, 특정 종류의 세균만 자라게 하거나 특정 생화학적 특성을 구별할 수 있는 선택/감별 배지(예: 초콜릿 한천 배지, MacConkey 한천 배지)를 동시에 사용하는 것이 일반적입니다. 초콜릿 한천 배지는 헤모필루스 인플루엔자(Haemophilus influenzae)나 나이세리아(Neisseria) 속 세균처럼 까다로운 영양 요구성을 가진 균의 성장을 돕기 위해 사용됩니다.
그렇다면 호흡기 검체의 표준 배양 기간은 얼마나 될까요? 일반적인 세균성 폐렴을 진단하기 위한 객담 배양의 경우, 보통 48시간(이틀) 동안 배양한 후 최종 판독을 하는 경우가 많습니다. 왜 소변 배양(24시간)보다 하루가 더 필요할까요? 몇 가지 이유가 있습니다.
첫째, 호흡기 감염의 원인균 중 일부는 소변 감염의 주 원인균인 대장균보다 성장 속도가 다소 느립니다. 예를 들어, 폐렴의 흔한 원인균인 헤모필루스 인플루엔자나 모락셀라 카타랄리스(Moraxella catarrhalis) 등은 최적의 성장을 위해 특별한 영양소(예: 초콜릿 한천 배지)가 필요하며, 집락이 충분히 자라 눈에 띄기까지 시간이 조금 더 걸릴 수 있습니다.
둘째, 정상 세균총과의 경쟁에서 병원균을 확인해야 하기 때문입니다. 배지 위에는 정상 세균총과 병원균이 함께 자라게 되는데, 때로는 정상 세균총의 성장 속도가 더 빠르거나 수가 훨씬 많아 병원균 집락을 가리거나 구별하기 어려울 수 있습니다. 48시간 정도 배양하면 병원균이 특징적인 집락 형태를 보이거나 우세하게 자라나는 것을 좀 더 명확하게 확인할 수 있는 시간을 확보할 수 있습니다. 검사실 전문가들은 배지 위에 자라난 다양한 균들 중에서 임상적으로 의미 있는 병원균(potential pathogen)을 경험과 지식에 기반하여 선별하고 동정하는 중요한 역할을 수행합니다.
셋째, 특정 병원균은 특별한 배양 조건이나 더 긴 배양 기간을 요구하기 때문입니다. 예를 들어, 레지오넬라(Legionella)균은 일반적인 배지에서는 자라지 않고 특수 배지(BCYE agar)에서 3
5일 이상 배양해야 하며, 노카르디아(Nocardia)균 감염이 의심될 경우에는 배양 기간을 1
2주 이상 연장해야 할 수도 있습니다.
특히 호흡기 감염에서 중요한 위치를 차지하는 결핵균(Mycobacterium tuberculosis)은 완전히 다른 이야기입니다. 결핵균은 앞서 언급했듯이 세대 시간이 12~24시간으로 극도로 느린 세균입니다. 따라서 결핵균 배양은 일반 세균 배양과는 별도로, 검체를 특수 처리(객담 내 다른 세균들을 제거하는 과정)한 후 결핵균 전용 배지(액체 배지인 MGIT 또는 고체 배지인 Ogawa, LJ 배지 등)에 접종하여 배양합니다.
그리고 그 배양 기간은 액체 배지의 경우 최대 6주, 고체 배지의 경우 최대 8주까지 소요될 수 있습니다 [8]. 이것이 바로 결핵 진단과 치료 경과 확인에 오랜 시간이 걸리는 근본적인 이유입니다. 물론 최근에는 배양보다 훨씬 빠른 분자 진단 검사(PCR)가 결핵 진단에 널리 활용되고 있지만, 약제 내성 결핵 진단 등을 위해서는 여전히 배양 검사가 필수적입니다.
진균(곰팡이)에 의한 폐렴이 의심될 경우에도 배양 기간은 길어집니다. 아스페르길루스(Aspergillus)나 칸디다(Candida)와 같은 진균은 세균보다 훨씬 느리게 자라기 때문에, 진균 배양용 특수 배지(예: Sabouraud dextrose agar)에 접종하여 최소 2주에서 4주 이상 배양하며 관찰해야 합니다.
요약해 보겠습니다. 객담 등 호흡기 검체 배양은 정상 세균총 오염이라는 어려움 속에서 실제 병원균을 찾아내는 과정입니다. 일반적인 세균성 폐렴 원인균 확인에는 보통 48시간의 배양 기간이 필요하며, 이는 일부 원인균의 느린 성장 속도와 정상 세균총과의 감별 필요성 때문입니다. 하지만 결핵균이나 진균과 같이 특별히 느리게 자라는 미생물이 의심될 경우에는 수 주에서 수 개월까지 배양 기간이 연장될 수 있습니다. 이처럼 호흡기 검체 배양은 검체 종류와 의심되는 원인균에 따라 매우 다양한 배양 기간과 접근법을 요구하는 복잡한 검사라고 할 수 있습니다. 다음으로는 또 다른 복잡한 환경, 바로 우리 장 속에 존재하는 미생물을 다루는 대변 배양에 대해 알아보겠습니다.
대변 배양: 장내 감염의 범인을 색출하라

갑작스러운 복통과 함께 설사, 구토 증상이 나타나면 우리는 흔히 '장염'을 의심합니다. 이러한 위장관 감염 증상이 세균성 감염에 의한 것으로 의심될 때, 의사는 원인균을 찾기 위해 대변 배양(Stool Culture) 검사를 의뢰할 수 있습니다. 대변 배양은 살모넬라(Salmonella), 이질균(Shigella), 캠필로박터(Campylobacter) 등 설사를 유발하는 특정 병원성 세균을 검출하는 것을 목표로 합니다. 그런데 대변 속 환경은 앞서 다룬 객담보다 훨씬 더 복잡하고 미생물로 가득 찬 곳입니다. 이 때문에 대변 배양 역시 특별한 접근 방식과 배양 기간이 필요합니다.
대변 검체가 가진 가장 큰 특징은 바로 엄청난 수와 종류의 '정상 장내 세균총(Normal Gut Flora)'이 존재한다는 점입니다. 우리 대장 속에는 약 100조 마리 이상의 미생물이 살고 있으며, 그 종류도 수백 종에 달하는 것으로 알려져 있습니다 [9]. 이들 대부분은 소화를 돕거나 면역 체계 조절에 기여하는 유익한 공생균이지만, 문제는 이 압도적으로 많은 정상 세균총 속에서 상대적으로 소수인 특정 병원균을 찾아내야 한다는 것입니다. 마치 엄청나게 붐비는 시장 한복판에서 특정 인물 한 명을 찾아내야 하는 어려운 임무와 같다고 할 수 있습니다.
따라서 대변 배양의 핵심 전략은 '선택과 배제'입니다. 즉, 정상 장내 세균총의 성장은 최대한 억제하면서, 우리가 찾고자 하는 특정 병원균만 선택적으로 잘 자라도록 유도하는 특수한 배지를 사용하는 것입니다. 이를 위해 대변 배양에서는 매우 다양한 종류의 선택 배지(Selective Media)와 감별 배지(Differential Media)가 동원됩니다.
예를 들어, MacConkey 한천 배지는 그람 음성균만 자라게 하면서 유당 분해 여부에 따라 집락 색깔을 다르게 하여 대장균과 같은 정상 세균총과 살모넬라, 이질균 같은 병원균(대부분 유당 분해 못함)을 일차적으로 구별하는 데 도움을 줍니다. SS 한천 배지(Salmonella-Shigella agar)나 XLD 한천 배지(Xylose Lysine Deoxycholate agar)는 담즙산염 등을 첨가하여 대부분의 정상 장내 세균총 성장을 강력하게 억제하고, 살모넬라나 이질균이 특징적인 색깔의 집락(예: SS 배지에서 살모넬라는 황화수소 생성으로 중심부가 검은색)을 형성하도록 설계되었습니다. 또한, 캠필로박터(Campylobacter) 균은 일반적인 배양 조건에서는 잘 자라지 않기 때문에, 특수 항생제가 첨가된 캠피 배지(Campy agar)를 사용하고 42°C의 미호기성(낮은 산소 농도) 조건에서 배양해야 합니다.
뿐만 아니라, 검체 내 소량으로 존재할 수 있는 살모넬라나 이질균을 증폭시키기 위해 증균 배지(Enrichment broth), 예를 들어 셀레나이트 F 배지(Selenite F broth)나 테트라티오네이트 배지(Tetraționate broth)에 검체를 먼저 접종하여 하룻밤 배양한 후, 다시 선택/감별 배지에 옮겨 심는(계대 배양) 과정을 거치기도 합니다. 이는 마치 용의자를 특정하기 전에 관련 증거들을 모아 수사망을 좁혀나가는 과정과 유사합니다.
자, 그렇다면 이렇게 복잡한 과정을 거치는 대변 배양의 표준 배양 기간은 얼마나 될까요? 일반적으로 대변 검체가 접종된 각종 선택/감별 배지들은 48시간에서 72시간(2-3일) 동안 배양한 후 최종 판독을 하게 됩니다. 왜 객담 배양(48시간)보다 조금 더 길거나 비슷할까요?
첫째, 다양한 종류의 선택/감별 배지를 사용하고 판독해야 하기 때문입니다. 각 배지마다 목표로 하는 병원균이 다르고, 특징적인 집락 형태나 색깔 변화가 나타나는 데 걸리는 시간이 조금씩 다를 수 있습니다. 또한, 증균 배지를 사용하는 경우에는 하룻밤의 증균 시간과 이후 계대 배양 시간이 추가로 필요합니다.
둘째, 캠필로박터와 같이 특별한 배양 조건과 시간이 필요한 균을 고려해야 하기 때문입니다. 캠필로박터는 42°C 미호기성 조건에서 최소 48시간, 때로는 72시간까지 배양해야 확실하게 검출할 수 있습니다. 따라서 일반 세균 배양과 캠필로박터 배양을 동시에 진행하고 결과를 종합하여 보고하게 됩니다.
셋째, 의심스러운 집락이 나타났을 때, 그것이 정말 병원균인지 확인하기 위한 추가적인 생화학적 검사나 혈청학적 검사(균 표면 항원 확인)가 필요할 수 있기 때문입니다. 이러한 동정 과정에 시간이 더 소요될 수 있습니다.
최근에는 대변 배양과 함께 또는 배양을 대체하여 특정 병원균의 유전자를 직접 검출하는 분자 진단 검사(PCR)나, 세균이 생산하는 독소를 검출하는 검사(예: 장출혈성 대장균(EHEC)의 Shiga 독소, 클로스트리듐 디피실(Clostridium difficile)의 독소 A/B 검사)가 많이 활용되고 있습니다. 이러한 검사들은 배양보다 훨씬 빠른 시간 안에 결과를 얻을 수 있다는 장점이 있지만, 검출할 수 있는 병원균의 종류가 제한적이거나 항생제 감수성 정보를 얻을 수 없다는 한계도 있습니다. 따라서 임상 상황에 따라 배양 검사와 비배양 검사를 적절히 조합하여 사용하는 것이 중요합니다.
요약하자면, 대변 배양은 압도적으로 많은 정상 장내 세균총 속에서 특정 설사 원인균을 찾아내는 어려운 과제입니다. 이를 위해 다양한 선택/감별 배지와 증균 배지, 그리고 특별한 배양 조건(캠필로박터)이 필요하며, 이 때문에 표준 배양 기간은 보통 48-72시간이 소요됩니다. 수많은 미생물이 공존하는 복잡한 환경 속에서 범인을 색출해내는 과정, 이것이 바로 대변 배양의 핵심이라고 할 수 있습니다. 이제 다음으로는 매우 위급한 상황에서 시행되는 뇌척수액 배양에 대해 알아보겠습니다. 뇌척수액 배양은 왜 신속함이 생명이면서도 일정한 배양 기간이 필요할까요?
뇌척수액(CSF) 배양: 뇌수막염 진단의 골든타임

갑작스러운 고열, 심한 두통, 목 경직 등의 증상이 나타난다면, 우리는 뇌와 척수를 둘러싸고 있는 막에 염증이 생기는 '뇌수막염(Meningitis)'을 의심해야 합니다. 특히 세균에 의해 발생하는 세균성 뇌수막염은 매우 빠르게 진행하여 심각한 신경학적 후유증을 남기거나 생명을 앗아갈 수 있는 초응급 질환입니다 [10]. 따라서 세균성 뇌수막염이 의심될 때는 즉시 뇌척수액(Cerebrospinal Fluid, CSF) 검사를 시행하여 원인균을 밝혀내고 신속하게 항생제 치료를 시작하는 것이 무엇보다 중요합니다. 마치 불길이 번지기 전에 초기에 진화해야 하는 화재 현장과도 같은 긴박한 상황인 것이지요.
뇌척수액은 뇌와 척수를 외부 충격으로부터 보호하고 영양분을 공급하며 노폐물을 제거하는 역할을 하는 맑은 액체입니다. 건강한 상태에서는 혈액과 마찬가지로 완전한 무균 상태를 유지해야 합니다. 따라서 뇌척수액 검사를 위해 허리뼈 사이로 바늘을 찔러 뇌척수액을 채취하는 요추 천자(Lumbar puncture)를 시행하여 얻은 검체에서 세균이 배양된다는 것은 세균성 뇌수막염을 강력하게 시사하는 결정적인 증거가 됩니다.
뇌척수액 검체는 몇 가지 중요한 특징을 가지고 있습니다. 우선, 채취할 수 있는 검체의 양이 매우 제한적입니다. 보통 성인 기준으로 몇 mL 정도만 얻을 수 있기 때문에, 이 소량의 검체로 염색 검사, 생화학 검사, 배양 검사 등 필요한 모든 검사를 효율적으로 수행해야 합니다. 또한, 뇌수막염의 주요 원인균 중 일부는 매우 까다로운 영양 요구성(fastidious)을 가지고 있어 일반적인 배지에서는 잘 자라지 못할 수 있습니다. 그리고 검체 채취 과정이나 취급 과정에서 오염되지 않도록 각별한 주의가 필요합니다.
이러한 특성을 고려하여 뇌척수액 배양은 신속하면서도 정확하게 원인균을 검출하는 것을 목표로 합니다. 검사실에 뇌척수액 검체가 도착하면 최우선 순위로 처리됩니다. 가장 먼저 그람 염색(Gram stain)을 실시하여 세균의 존재 유무와 형태, 염색성을 신속하게 확인합니다. 그람 염색 결과는 배양 결과가 나오기 전에 의사가 경험적 항생제를 선택하는 데 매우 중요한 단서를 제공합니다. 예를 들어, 그람 양성 알균 쌍(diplococci)이 보이면 폐렴알균(Streptococcus pneumoniae)을, 그람 음성 알균 쌍이 보이면 수막알균(Neisseria meningitidis)을 우선적으로 의심할 수 있습니다.
배양을 위해서는 어떤 배지를 사용할까요? 뇌수막염의 주요 원인균들을 놓치지 않기 위해 최소 두 종류의 고체 배지에 접종하는 것이 표준입니다. 하나는 대부분의 세균이 잘 자라는 혈액 한천 배지(Blood agar)이고, 다른 하나는 초콜릿 한천 배지(Chocolate agar)입니다.
초콜릿 한천 배지는 가열 처리된 혈액 성분(X 인자, V 인자 등)을 함유하고 있어, 헤모필루스 인플루엔자(Haemophilus influenzae)나 수막알균(Neisseria meningitidis)과 같이 혈액 한천 배지에서는 잘 자라지 못하는 까다로운 균들의 성장을 돕습니다. 마치 특별한 영양식을 제공하는 것과 같다고 할 수 있습니다. 또한, 검체 내 소량의 균을 증폭시키기 위해 영양분이 풍부한 액체 배지(예: Thioglycollate broth)에도 함께 접종하는 것이 일반적입니다. 접종된 배지들은 세균 성장을 촉진하기 위해 이산화탄소(CO2) 농도를 5-10%로 높인 배양기에서 35-37°C로 배양합니다.
그렇다면 뇌척수액 배양의 표준 배양 기간은 얼마나 될까요? 세균성 뇌수막염의 주요 원인균인 폐렴알균, 수막알균, 헤모필루스 인플루엔자 등은 비교적 성장 속도가 빨라서 보통 24시간에서 48시간 이내에 배지에서 집락이 관찰되는 경우가 많습니다 [11]. 따라서 배양 시작 후 매일 배지를 주의 깊게 관찰하여 균이 자라는지 확인하고, 균이 자라면 즉시 동정 검사와 항생제 감수성 검사를 진행하여 최대한 빨리 최종 결과를 보고하는 것이 중요합니다.
하지만 최종적으로 '음성(균 배양 안 됨)' 보고를 하기까지는 최소 48시간에서 72시간(2-3일) 동안 배양을 유지하는 것이 일반적입니다. 왜냐하면 일부 균주나, 환자가 항생제 치료를 이미 받고 있는 상태에서 채취된 검체의 경우에는 세균의 성장이 느리거나 억제되어 늦게 나타날 수 있기 때문입니다. 너무 일찍 배양을 종료하면 드물지만 중요한 원인균을 놓칠 위험이 있습니다. 따라서 응급 상황임에도 불구하고, 위음성 결과를 최소화하기 위해 일정 기간 동안의 관찰이 반드시 필요한 것입니다. 만약 진균성 또는 결핵성 뇌수막염이 의심되는 경우에는 앞서 설명한 바와 같이 훨씬 더 긴 배양 기간(수 주 이상)이 필요합니다.
최근에는 뇌척수액 검체에서도 분자 진단 검사(PCR)의 활용이 증가하고 있습니다. 특히 여러 종류의 세균 및 바이러스성 뇌수막염 원인 병원체를 동시에 검출할 수 있는 다중 PCR 패널 검사(Multiplex PCR panel)는 배양보다 훨씬 빠른 시간(몇 시간 이내)에 결과를 제공하여 신속 진단에 큰 도움을 주고 있습니다 [12]. 하지만 PCR 검사 역시 검출할 수 있는 병원체의 종류가 패널에 포함된 것으로 제한되고, 항생제 감수성 정보를 제공하지 못하며, 드물지만 위양성/위음성 결과가 나올 수 있다는 한계를 가지고 있습니다. 따라서 여전히 뇌척수액 배양은 세균성 뇌수막염 진단의 '표준 검사(gold standard)'로서 중요한 위치를 차지하고 있으며, PCR 결과와 함께 종합적으로 해석하는 것이 중요합니다.
정리하면, 뇌척수액 배양은 세균성 뇌수막염이라는 초응급 질환을 진단하는 데 필수적인 검사입니다. 신속한 결과 보고가 중요하지만, 주요 원인균의 영양 요구성과 잠재적인 성장 지연 가능성을 고려하여 초콜릿 한천 배지를 포함한 여러 배지에 접종하고 최소 48-72시간 동안 배양하는 것이 표준입니다. 그람 염색과 분자 진단 검사가 신속 진단에 도움을 주지만, 배양 검사는 살아있는 원인균을 확인하고 항생제 감수성 정보를 얻는 데 여전히 중요한 역할을 수행합니다. 이제까지 주로 세균 배양에 초점을 맞춰 이야기했다면, 다음으로는 또 다른 중요한 미생물 그룹인 진균 배양에 대해 알아보겠습니다. 진균 배양은 왜 이렇게 '끈기 있는 기다림'을 요구하는 걸까요?
진균 배양: 끈기 있는 기다림의 미학
지금까지 우리는 주로 세균 배양에 대해 이야기하며 검체 종류별 배양 기간의 차이를 살펴보았습니다. 그런데 우리 몸에 감염을 일으키는 미생물에는 세균만 있는 것이 아니지요. 곰팡이나 효모와 같은 진균(Fungi) 역시 다양한 감염병의 원인이 될 수 있습니다. 무좀이나 칸디다 질염과 같은 비교적 흔한 표재성 감염부터, 면역력이 저하된 환자에게 치명적일 수 있는 폐 아스페르길루스증이나 혈류 감염과 같은 심부 진균증까지 그 종류와 심각성은 매우 다양합니다. 이러한 진균 감염이 의심될 때, 정확한 진단을 위해 진균 배양(Fungal Culture) 검사가 필요합니다.

그런데 진균 배양 결과를 기다려 본 경험이 있으시다면, 아마도 세균 배양보다 훨씬 더 오랜 시간이 걸린다는 것을 알고 계실 겁니다. 짧게는 2주, 길게는 4주 이상, 심지어 그보다 더 오래 걸리는 경우도 있습니다. 도대체 왜 진균 배양은 이렇게 '끈기 있는 기다림'을 요구하는 걸까요?
가장 근본적인 이유는 앞서 '왜 미생물마다 자라는 속도가 다를까?' 섹션에서 설명했듯이, 진균 자체가 세균보다 훨씬 느리게 자라는 생물학적 특성을 가지고 있기 때문입니다. 다시 한번 강조하자면, 진균은 사람 세포와 유사한 진핵세포(eukaryotic cell)로, 세균의 원핵세포(prokaryotic cell)보다 훨씬 복잡한 세포 구조를 가지고 있습니다. 핵막으로 둘러싸인 핵, 미토콘드리아, 소포체 등 다양한 세포 소기관을 갖추고 있지요. 이
러한 복잡한 세포 구조는 세포 분열 과정 역시 더 많은 단계와 시간이 필요함을 의미합니다. 또한, 진균의 대사 속도 자체가 세균보다 느리고, 세포벽 성분(키틴 등) 합성 등에도 상당한 시간과 에너지가 소요됩니다. 결과적으로 진균의 세대 시간은 세균보다 훨씬 길어서, 눈에 보이는 집락을 형성하고 특징적인 형태(균사, 포자 등)를 나타내기까지 오랜 시간이 걸리는 것입니다.
이러한 느린 성장 속도 때문에 진균 배양에는 특별한 배지와 배양 조건, 그리고 충분한 배양 기간이 필요합니다. 진균 배양에 가장 흔하게 사용되는 배지는 사부로 포도당 한천 배지(Sabouraud Dextrose Agar, SDA)입니다. 이 배지는 비교적 낮은 pH(약 5.6)와 높은 포도당 농도를 가지고 있어 세균의 성장은 억제하면서 진균의 성장을 촉진하는 특성이 있습니다. 또한, 검체 내에 존재할 수 있는 세균 오염을 막기 위해 항생제(예: 클로람페니콜, 겐타마이신)를 첨가하고, 빠르게 자라는 오염성 곰팡이의 성장을 억제하기 위해 사이클로헥시미드(cycloheximide)를 첨가한 배지를 함께 사용하기도 합니다.
배양 온도 역시 중요한 고려 사항입니다. 많은 병원성 진균은 사람의 체온과 비슷한 35-37°C에서 잘 자라지만, 일부 진균, 특히 환경에서 유래하는 곰팡이들은 이보다 낮은 온도인 25-30°C에서 더 특징적인 형태(예: 포자 형성)를 잘 나타냅니다. 따라서 의심되는 균종이나 검체 종류에 따라 두 가지 온도를 병행하여 배양하는 경우도 있습니다. 특히 이형성 진균(dimorphic fungi)이라고 불리는 일부 심부 진균증 원인균(예: Histoplasma capsulatum, Blastomyces dermatitidis)은 37°C에서는 효모 형태로, 25-30°C에서는 곰팡이(균사) 형태로 자라는 특징을 가지므로, 온도에 따른 형태 변화를 확인하는 것이 동정에 중요합니다.
이제 가장 중요한 배양 기간입니다. 진균 배양은 검체 종류와 의심되는 균종에 따라 요구되는 기간이 크게 달라지지만, 일반적으로 세균 배양보다 훨씬 깁니다.
- 피부, 손발톱, 모발 등 표재성 검체: 무좀이나 백선 등의 원인균인 피부사상균(dermatophytes)을 검출하기 위한 배양은 보통 2주에서 4주 정도 소요됩니다.
- 객담, 기관지 세척액, 조직 등 심부 검체: 폐 아스페르길루스증이나 칸디다 감염 등 심부 진균증이 의심되는 경우, 원인균을 확인하기 위해 최소 4주 동안 배양하는 것이 일반적입니다 [13].
- 혈액: 혈액 내 진균 감염(진균혈증)이 의심되는 경우, 혈액 배양 병을 사용하지만 일반 세균 배양보다 더 길게, 최소 2주 이상, 때로는 4주까지 배양 기간을 연장하여 관찰해야 합니다. 특히 자동 혈액 배양 시스템은 진균 성장 신호를 세균보다 늦게 감지할 수 있습니다.
- 특정 심부 진균: 히스토플라스마(Histoplasma)나 콕시디오이데스(Coccidioides)와 같은 특정 풍토성 진균(endemic fungi) 감염이 의심되는 경우에는 매우 느리게 자라기 때문에 6주 이상, 심지어 8주까지 배양 기간이 필요할 수도 있습니다.
왜 이렇게 긴 시간이 필요할까요? 단순히 느리게 자란다는 것 외에도, 진균을 정확하게 동정하기 위해서는 특징적인 집락 형태뿐만 아니라 현미경으로 관찰했을 때 나타나는 균사(hyphae)의 모양, 포자(spore) 형성 방식 등 미세 구조를 확인하는 것이 매우 중요하기 때문입니다. 이러한 구조들이 충분히 발달하고 명확하게 관찰되기까지 상당한 시간이 필요한 경우가 많습니다. 마치 나무를 심고 나서 꽃이 피고 열매가 맺히는 것을 확인해야 어떤 종류의 나무인지 정확히 알 수 있는 것처럼, 진균 역시 충분히 자라서 자신만의 특징적인 모습을 드러낼 때까지 기다려야 하는 것입니다.
물론, 진균 감염 진단에서도 배양 검사의 오랜 시간을 보완하기 위한 다른 방법들이 활용됩니다. 검체를 KOH(수산화칼륨) 용액으로 처리하여 직접 현미경으로 관찰하면 효모나 균사체의 존재를 비교적 빠르게 확인할 수 있습니다. 또한, 특정 진균의 항원(예: 아스페르길루스 갈락토만난 항원, 칸디다 베타-D-글루칸)이나 항체를 혈액 또는 다른 체액에서 검출하는 혈청학적 검사, 그리고 진균의 DNA를 직접 검출하는 분자 진단 검사(PCR) 등도 신속 진단에 큰 도움을 주고 있습니다 [14].
하지만 이러한 검사들 역시 민감도나 특이도에 한계가 있거나, 검출 가능한 균종이 제한적일 수 있습니다. 따라서 진균 배양은 여전히 진균 감염 진단의 확진 검사(confirmatory test)로서, 그리고 항진균제 감수성 검사를 위한 균주 확보 차원에서 매우 중요한 역할을 담당하고 있습니다.
결론적으로, 진균 배양은 진균 자체의 느린 성장 속도와 복잡한 세포 구조, 그리고 정확한 동정을 위한 형태학적 특징 관찰의 필요성 때문에 세균 배양보다 훨씬 긴 배양 기간(최소 2주 ~ 4주 이상)을 요구합니다. 이 기다림은 정확한 진단과 효과적인 치료를 위한 필수적인 과정이며, 진균 감염의 복잡성을 이해하는 중요한 단서가 됩니다. 이제 마지막으로, 산소를 싫어하는 특별한 세균들, 혐기성 세균 배양에 대해 알아보겠습니다. 이들은 왜 또 다른 배양 기간과 주의사항을 필요로 할까요?
혐기성 세균 배양: 산소를 피하는 은둔자들
지금까지 살펴본 대부분의 미생물 배양은 공기 중의 산소가 있는 환경, 즉 호기성(aerobic) 조건에서 이루어집니다. 하지만 우리 몸의 특정 부위, 예를 들어 깊은 상처 부위, 농양(abscess), 복강 내, 또는 치주 질환 부위 등에는 산소가 거의 없거나 매우 부족한 환경이 존재합니다. 그리고 이러한 환경을 선호하며 살아가는 특별한 세균들이 있습니다. 바로 '혐기성 세균(Anaerobic Bacteria)'입니다. 이들은 산소가 있으면 오히려 성장이 억제되거나 심지어 죽기 때문에 '산소를 싫어하는 세균'이라고 불립니다. 박테로이데스(Bacteroides), 클로스트리듐(Clostridium), 푸소박테리움(Fusobacterium) 등이 대표적인 혐기성 세균에 속합니다.
혐기성 세균은 종종 심각한 감염, 예를 들어 조직 괴사, 가스 괴저, 복막염, 흡인성 폐렴, 뇌 농양 등을 유발할 수 있습니다. 따라서 이러한 감염이 의심될 때는 원인균을 밝혀내기 위해 혐기성 배양(Anaerobic Culture)을 시행해야 합니다. 그런데 혐기성 세균은 산소에 매우 민감하기 때문에, 검체 채취부터 운송, 배양에 이르기까지 모든 과정에서 산소 노출을 최소화하는 것이 극도로 중요합니다. 마치 빛을 싫어하는 드라큘라를 다루듯 조심해야 하는 것이지요.
검체 채취 시에는 면봉보다는 주사기를 이용하여 농양이나 체액을 직접 흡인하는 방식이 선호됩니다. 채취된 검체는 즉시 공기 노출을 차단할 수 있는 혐기성 수송 배지(anaerobic transport medium)에 넣거나, 주사기 바늘 끝을 고무마개 등으로 막아 산소 유입을 막은 상태로 신속하게 검사실로 운송해야 합니다. 검사실에 도착한 검체는 가능한 한 빨리, 산소가 제거된 특수한 작업 환경(예: 혐기성 챔버(anaerobic chamber) 또는 가스팩을 이용한 혐기성 항아리(anaerobic jar)) 내에서 혐기성 배지에 접종되어야 합니다.
혐기성 배양에 사용되는 배지는 일반적인 세균 배양에 사용되는 배지와 유사하지만, 혐기성 세균의 성장을 돕기 위해 혈액, 비타민 K, 헤민 등이 첨가된 브루셀라 한천 배지(Brucella agar)나 티오글리콜레이트 액체 배지(Thioglycollate broth) 등이 흔히 사용됩니다. 티오글리콜레이트 배지는 배지 내 산소 농도 구배를 만들어, 혐기성 세균은 산소가 없는 배지 바닥 부분에서, 호기성 세균은 산소가 풍부한 표면에서 자라도록 하여 균의 산소 요구성을 확인하는 데 도움을 줍니다. 접종된 배지들은 산소가 완전히 제거되고 대신 질소, 수소, 이산화탄소 혼합 가스로 채워진 혐기성 환경에서 35-37°C로 배양됩니다.
자, 그렇다면 혐기성 세균 배양에는 얼마나 시간이 걸릴까요? 일반적으로 혐기성 세균은 호기성 또는 통성 혐기성 세균에 비해 성장 속도가 느린 경향이 있습니다. 따라서 배양 기간도 일반 세균 배양보다 더 길게 요구됩니다.
최소 48시간에서 72시간(2-3일) 동안 배양한 후 첫 번째 판독을 실시하여 집락이 자랐는지 확인합니다. 만약 균이 자랐다면, 의심되는 집락을 골라 그람 염색을 하고 추가적인 동정 검사를 진행합니다. 하지만 최종적으로 '혐기성균 배양 안 됨'이라는 음성 보고를 하기까지는 보통 5일에서 7일 정도 배양을 지속하는 것이 일반적입니다 [15].
왜 이렇게 더 긴 배양 기간이 필요할까요? 앞서 언급했듯이, 많은 병원성 혐기성 세균들이 상대적으로 느리게 자라기 때문입니다. 또한, 혐기성 조건에서 자란 집락은 크기가 작거나 특징이 뚜렷하지 않은 경우가 있어 확인에 더 주의가 필요하며, 정확한 동정을 위한 특수 검사(예: 가스 액체 크로마토그래피를 이용한 대사산물 분석)에 시간이 더 소요될 수도 있습니다. 5-7일이라는 기간은 이러한 느리게 자라는 혐기성 병원균을 놓치지 않고 검출하기 위한 충분한 시간을 확보하기 위함입니다.
혐기성 배양 결과 해석 시에는 몇 가지 주의할 점이 있습니다. 우리 몸의 피부나 점막 표면에는 정상적으로 존재하는 혐기성 세균들도 많습니다. 따라서 검체 채취 부위가 원래 혐기성 세균이 존재할 수 있는 곳(예: 구강, 질)이라면, 배양된 균이 실제 감염의 원인인지 아니면 단순 오염이나 정상 세균총인지 신중하게 판단해야 합니다. 또한, 혐기성 감염은 종종 여러 종류의 세균(혐기성균과 호기성균 혼합)에 의해 발생하는 다균 감염(polymicrobial infection)인 경우가 많으므로, 배양 결과에서 여러 균이 함께 동정될 수 있습니다.
요약하면, 혐기성 세균 배양은 산소에 민감한 혐기성 세균을 검출하기 위한 특수한 검사입니다. 검체 채취, 운송, 배양 전 과정에서 산소 노출을 최소화해야 하며, 혐기성 세균의 느린 성장 속도를 고려하여 최소 48-72시간 초기 판독 후 최종 음성 보고까지 5-7일간 배양하는 것이 일반적입니다. 산소를 피해 숨어있는 이 은둔자들을 찾아내는 과정은 정확한 진단과 적절한 치료(특히 항생제 선택)에 매우 중요합니다.
지금까지 우리는 혈액, 소변, 객담, 대변, 뇌척수액, 그리고 진균 및 혐기성 세균 배양까지 다양한 검체와 미생물 종류에 따른 배양 기간의 차이와 그 이유를 자세히 살펴보았습니다. 하지만 배양 기간에 영향을 미치는 요인은 이것이 전부일까요? 그렇지 않습니다. 다음 섹션에서는 검체 종류 외에 배양 결과와 소요 시간에 영향을 줄 수 있는 다른 중요한 요인들에 대해 알아보겠습니다.
배양 기간에 영향을 미치는 추가 요인들
우리는 지금까지 주로 검체의 종류와 그 안에 존재할 수 있는 미생물의 특성(성장 속도, 산소 요구성, 영양 요구성 등)이 배양 기간을 결정하는 주요 요인임을 살펴보았습니다. 혈액 배양이 5일, 소변 배양이 1-2일, 객담 배양이 2일 이상, 대변 배양이 2-3일, 뇌척수액 배양이 2-3일, 진균 배양이 수 주 이상, 혐기성 배양이 5-7일 걸리는 이유를 이해했지요. 하지만 실제 임상 현장에서 미생물 배양 결과가 나오기까지 걸리는 시간은 이러한 표준적인 기간 외에도 여러 가지 다른 요인들에 의해 영향을 받을 수 있습니다. 마치 요리 시간이 레시피뿐만 아니라 재료의 신선도, 불의 세기, 요리사의 숙련도에 따라 달라질 수 있는 것처럼 말입니다. 어떤 요인들이 있을까요?
가장 중요하고 흔하게 영향을 미치는 요인 중 하나는 바로 '환자의 항생제 사용 여부'입니다. 만약 환자가 검체를 채취하기 전에 이미 항생제를 투여받고 있었다면, 검체 내에 존재하던 원인 미생물이 항생제에 의해 손상되거나 일시적으로 성장이 억제될 수 있습니다. 이 경우, 배양을 하더라도 균이 전혀 자라지 않거나(이를 위음성(false negative) 결과라고 합니다), 자라더라도 매우 느리게 자라서 표준 배양 기간보다 훨씬 더 오랜 시간이 걸릴 수 있습니다 [16]. 이는 마치 해충을 잡으려고 약을 뿌렸는데, 일부 해충이 죽지 않고 잠시 기절해 있다가 나중에 깨어나는 것과 비슷하다고 할 수 있습니다. 이러한 영향을 최소화하기 위해, 특히 혈액 배양에서는 항생제 성분을 흡착하여 제거하는 특수 수지(resin)가 포함된 배양 병을 사용하기도 합니다. 하지만 가장 좋은 것은 가능하다면 항생제 치료를 시작하기 전에 배양 검사를 위한 검체를 먼저 채취하는 것입니다.
아니, 그럼 항생제 먹고 있으면 검사 하나마나 아니야? 괜히 기다리기만 하는 거잖아!
물론 항생제 사용은 배양 검사 결과에 영향을 줄 수 있지만, 그렇다고 검사가 전혀 의미 없는 것은 아닙니다. 첫째, 항생제를 사용했음에도 불구하고 균이 배양된다면, 이는 해당 항생제에 내성을 가진 균일 가능성을 시사하는 중요한 정보가 될 수 있습니다. 둘째, 앞서 언급한 항생제 제거 배지 등을 사용하면 어느 정도 영향을 줄일 수 있습니다. 셋째, 배양이 되지 않더라도 다른 검사 결과(예: 염증 수치, 영상 검사)와 임상 증상을 종합하여 진단과 치료 방향을 결정할 수 있습니다. 따라서 항생제 사용 중이라도 의사가 필요하다고 판단하면 배양 검사를 시행하는 것이 일반적이며, 검사 결과 해석 시 항생제 사용력을 반드시 고려해야 합니다.
다음으로 중요한 요인은 '검체 채취 및 처리의 적절성'입니다. 아무리 좋은 배지와 배양 시스템을 사용하더라도, 시작점인 검체 자체가 잘못되었다면 정확한 결과를 기대하기 어렵습니다. 부적절한 검체 채취는 크게 두 가지 문제를 야기합니다. 하나는 오염(contamination)입니다. 예를 들어, 소변 채취 시 요도 주변을 제대로 닦지 않거나, 객담 채취 시 침이 과도하게 섞이거나, 혈액 채취 시 피부 소독이 불충분하면 실제 감염 원인균이 아닌 주변의 정상 세균총이나 피부 상재균이 검체에 혼입될 수 있습니다. 이렇게 오염된 검체를 배양하면 엉뚱한 균이 자라나와 결과를 잘못 해석하게 만들 수 있습니다. 다른 하나는 검체 양 부족입니다. 특히 혈액 배양이나 뇌척수액 배양처럼 원래 균 수가 적을 수 있는 검체는 충분한 양을 채취하는 것이 검출률을 높이는 데 매우 중요합니다.
채취된 검체를 어떻게 보관하고 운송하는지도 결과에 큰 영향을 미칩니다. 검체를 채취한 후 너무 오랫동안 실온에 방치하거나 부적절한 온도(너무 높거나 낮게)에서 보관하면, 검체 내 미생물이 죽거나 반대로 과도하게 증식하여 실제 환자의 상태를 반영하지 못하게 될 수 있습니다. 특히 혐기성 세균 배양 검체처럼 산소 노출에 민감한 경우에는 더욱 신속하고 적절한 운송이 필수적입니다. 따라서 각 검체 종류별로 권장되는 보관 온도와 운송 시간을 준수하는 것이 매우 중요합니다 [17]. 마치 신선 식품을 적정 온도에서 보관하고 유통해야 품질이 유지되는 것과 같습니다.
검사실 내부적인 요인들도 배양 기간과 결과에 영향을 줄 수 있습니다. 사용되는 배지의 종류와 품질이 미생물 성장에 직접적인 영향을 미칩니다. 유효 기간이 지났거나 잘못 만들어진 배지, 또는 특정 미생물 성장에 필요한 영양소가 부족한 배지를 사용하면 균이 잘 자라지 않거나 느리게 자랄 수 있습니다. 또한, 배양기의 온도, 습도, 이산화탄소 농도 등이 정확하게 유지되지 않는 경우에도 미생물 성장 속도가 저하될 수 있습니다. 검사실에서는 이러한 배지와 장비의 품질 관리를 정기적으로 수행하여 검사의 정확성과 신뢰성을 유지하기 위해 노력합니다.
마지막으로, 미생물 자체의 요인도 무시할 수 없습니다. 같은 종류의 미생물이라 하더라도 균주(strain)에 따라 약간의 유전적 차이가 있을 수 있으며, 이로 인해 성장 속도나 영양 요구성, 항생제 내성 패턴 등이 다르게 나타날 수 있습니다. 어떤 균주는 다른 균주보다 더 까다롭거나 느리게 자랄 수 있으며, 이는 예측했던 표준 배양 기간을 벗어나는 결과를 초래할 수도 있습니다.
결론적으로, 미생물 배양 기간은 단순히 검체 종류에 의해서만 결정되는 것이 아니라, 환자의 항생제 사용 여부, 검체 채취, 보관, 운송의 적절성, 검사실의 배지 및 장비 품질 관리 상태, 그리고 미생물 균주의 특성 등 다양한 요인들의 복합적인 영향을 받습니다. 따라서 표준 배양 기간은 일반적인 가이드라인일 뿐, 실제 결과가 나오기까지 걸리는 시간은 사례별로 다소 차이가 있을 수 있다는 점을 이해하는 것이 중요합니다. 이러한 변수들을 최소화하고 가장 정확하고 신속한 결과를 얻기 위해 의료진과 검사실 전문가들은 긴밀하게 협력하며 최선을 다하고 있습니다.
하지만 과학 기술은 끊임없이 발전하고 있습니다. 과연 이 지루하게 느껴질 수 있는 기다림의 시간을 줄이기 위한 노력은 없을까요? 다음 섹션에서는 미생물 배양 기간을 단축하고 진단의 효율성을 높이기 위한 최신 기술과 미래 전망에 대해 이야기해 보겠습니다.
기다림을 줄이기 위한 노력 : 신속 동정 기술의 발전
미생물 배양 검사가 감염병 진단에 필수적이라는 사실은 변함없지만, 결과를 얻기까지 며칠씩 기다려야 한다는 점은 분명한 한계입니다. 특히 패혈증이나 뇌수막염과 같이 시간이 생명과 직결되는 응급 상황에서는 하루라도, 아니 몇 시간이라도 더 빨리 원인균을 알아내고 적절한 치료를 시작하는 것이 환자의 예후에 결정적인 영향을 미칩니다. 이러한 임상 현장의 요구에 부응하기 위해, 과학자들과 의료 전문가들은 전통적인 배양법의 시간적 한계를 극복하고 미생물을 더 빠르고 정확하게 진단하기 위한 다양한 신기술들을 개발하고 도입해 왔습니다. 마치 느린 증기 기관차 시대에서 초고속 열차 시대로 발전해 온 것처럼, 미생물 진단 분야 역시 혁신적인 변화를 겪고 있는 것이지요.
기존 배양 과정 자체를 개선하려는 노력 중 하나가 바로 앞서 혈액 배양에서 언급했던 '자동화 배양 시스템'의 도입입니다. 과거에는 검사실 직원이 일일이 배양 병을 관찰하며 균의 성장(혼탁도 변화 등)을 확인해야 했지만, 자동화 시스템은 미생물이 자라면서 내뿜는 이산화탄소(CO2)나 산소 소모량 등을 실시간으로 감지하여 양성 신호를 즉시 알려줍니다. 이를 통해 24시간 내내 배양 상태를 모니터링하고 양성 검출까지 걸리는 시간을 단축할 수 있게 되었습니다. 또한, 배양 병을 자동으로 흔들어주어 미생물 성장 속도를 높이는 효과도 있습니다.
하지만 자동화 시스템이 배양 자체의 속도를 획기적으로 줄여주는 것은 아닙니다. 미생물이 센서로 감지될 만큼 충분히 증식하기까지의 시간은 여전히 필요하기 때문이지요. 진짜 혁신은 배양된 미생물을 동정하는(이름을 알아내는) 단계에서 이루어졌습니다. 과거에는 배양된 집락을 대상으로 여러 가지 생화학적 검사(당 분해 능력, 효소 활성 등)를 조합하여 균의 종류를 추정했는데, 이 과정에만 하루 이상이 소요되는 경우가 많았습니다.

이러한 동정 시간을 극적으로 단축시킨 주인공이 바로 '질량 분석법(Mass Spectrometry)', 특히 'MALDI-TOF MS(Matrix-Assisted Laser Desorption/Ionization Time-Of-Flight Mass Spectrometry)' 기술입니다. 이름이 매우 길고 복잡하게 들리지만, 원리는 생각보다 흥미롭습니다. MALDI-TOF MS는 배양된 미생물 집락의 일부를 채취하여 특수 처리한 후, 레이저를 쏘아 미생물을 구성하는 단백질(주로 리보솜 단백질)들을 기화시키고 이온화시킵니다. 이 이온화된 단백질들은 전기장 속에서 비행 시간 분석관(Time-Of-Flight analyzer)을 통과하게 되는데, 이때 질량이 작은 단백질은 가볍기 때문에 더 빨리 날아가고, 질량이 큰 단백질은 무겁기 때문에 더 느리게 날아갑니다.
검출기에 도달하는 시간 차이를 측정하면 각 단백질의 질량을 정확하게 알 수 있고, 이를 통해 해당 미생물만이 가지는 고유한 '단백질 지문(protein fingerprint)' 스펙트럼을 얻을 수 있습니다. 이 스펙트럼을 이미 구축된 방대한 미생물 데이터베이스와 비교하면 단 몇 분 만에 매우 정확하게 미생물의 종류를 동정할 수 있습니다 [18]. 마치 사람마다 고유한 지문이 있듯이, 미생물마다 고유한 단백질 패턴을 이용하여 신원을 확인하는 첨단 기술인 셈입니다. MALDI-TOF MS의 도입으로, 과거 하루 이상 걸렸던 균 동정 시간을 불과 몇 분으로 단축함으로써 전체 검사 소요 시간을 크게 줄이는 데 혁혁한 공을 세웠습니다.
아예 배양 과정 자체를 건너뛰거나 대폭 줄이는 방법은 없을까요? 바로 '분자 진단 검사(Molecular Diagnostics)'가 그 해답을 제시하고 있습니다. 분자 진단 검사는 배양을 통해 미생물을 증식시키는 대신, 검체(혈액, 소변, 객담, 뇌척수액 등) 안에 존재하는 특정 미생물의 고유한 유전 물질(DNA 또는 RNA)을 직접 검출하고 증폭하여 그 존재를 확인하는 방법입니다. 가장 대표적인 기술이 바로 중합 효소 연쇄 반응(Polymerase Chain Reaction, PCR)입니다. PCR은 검체 내에 극미량으로 존재하는 특정 미생물의 유전자를 마치 복사기처럼 수백만 배 이상 증폭시켜 검출 가능한 수준으로 만드는 기술입니다.
분자 진단 검사는 배양 과정이 필요 없거나 최소화되기 때문에 매우 신속하게 결과를 얻을 수 있다는 엄청난 장점을 가집니다. 보통 몇 시간 이내에 결과 확인이 가능하며, 민감도 또한 매우 높아 소량의 미생물도 효과적으로 검출할 수 있습니다. 특히 배양이 어렵거나 매우 오래 걸리는 미생물(예: 결핵균, 일부 바이러스, 클라미디아 등)의 진단에 매우 유용하게 활용되고 있습니다.
또한, 최근에는 하나의 검체에서 여러 종류의 병원체(세균, 바이러스, 진균 등)를 동시에 검출할 수 있는 '다중 분자 진단 패널(Multiplex Molecular Panel)' 검사가 개발되어 패혈증, 뇌수막염, 호흡기 감염, 위장관 감염 등의 원인균을 신속하게 감별하는 데 큰 도움을 주고 있습니다 [19]. 예를 들어, 패혈증이 의심되는 환자의 혈액에서 배양 없이 직접 주요 원인균 20-30종과 일부 항생제 내성 유전자를 몇 시간 만에 확인하는 식입니다.
하지만 분자 진단 검사에도 몇 가지 한계점은 분명히 존재합니다. 첫째, 분자 진단은 살아있는 미생물과 죽은 미생물의 유전자를 구분하지 못합니다. 따라서 치료 후에도 죽은 균의 유전자가 남아있어 양성으로 나올 수 있으며, 실제 감염이 아닌 단순 집락(colonization) 상태와 감염을 구별하기 어려울 수 있습니다.
둘째, PCR 검사는 미리 알고 있는 특정 유전자 염기서열을 타겟으로 하기 때문에, 예상치 못한 새로운 병원체나 변종은 검출하지 못할 수 있습니다. 셋째, 그리고 가장 중요한 한계점 중 하나는 대부분의 분자 진단 검사가 항생제 감수성(어떤 항생제가 효과적인지)에 대한 직접적인 정보를 제공하지 못한다는 것입니다. 물론 일부 주요 항생제 내성 유전자를 검출할 수는 있지만, 실제 균이 어떤 항생제에 반응하는지를 종합적으로 알려면 여전히 배양 기반의 감수성 검사가 필요한 경우가 많습니다.
이처럼 미생물 진단 분야는 자동화 배양 시스템, MALDI-TOF MS, 분자 진단 검사 등 혁신적인 기술들의 발전에 힘입어 점점 더 빠르고 정확해지고 있습니다. 이러한 신속 기술들은 특히 응급 상황에서 환자의 진단과 치료 결정에 큰 도움을 주고 있으며, 앞으로도 그 역할은 더욱 커질 것으로 기대됩니다. 하지만 이러한 첨단 기술들이 과연 전통적인 미생물 배양을 완전히 대체할 수 있을까요? 다음 섹션에서는 배양 없는 진단의 가능성과 미래 전망에 대해 좀 더 깊이 생각해 보겠습니다.
배양 없는 진단의 시대가 올까? - 미래 전망
MALDI-TOF MS나 분자 진단 검사(PCR)와 같은 신속 기술들의 눈부신 발전은 우리에게 '과연 언젠가는 미생물 배양이라는 오래고 더딘 과정 없이도 감염병을 진단할 수 있는 시대가 오지 않을까?'라는 질문을 던지게 합니다. 검체를 채취하자마자 몇 시간, 아니 몇 분 안에 원인균과 최적의 치료법까지 알아낼 수 있다면, 감염병과의 싸움에서 훨씬 유리한 고지를 점할 수 있을 것입니다. 실제로 이러한 목표를 향한 연구 개발은 지금도 활발히 진행되고 있습니다.

미래의 미생물 진단 기술로 주목받는 분야 중 하나는 '차세대 염기서열 분석(Next-Generation Sequencing, NGS)' 기술을 임상 미생물학에 적용하는 것입니다. NGS는 특정 유전자 몇 개만 증폭하는 PCR과 달리, 검체 안에 존재하는 모든 미생물들의 전체 유전체(genome) 또는 특정 유전자 영역(예: 16S rRNA 유전자)을 한꺼번에 읽어내는 강력한 기술입니다 [20].
이를 통해 배양 과정 없이도 검체 내에 어떤 종류의 미생물들이 얼마나 존재하는지 상세하게 파악할 수 있으며, 심지어 기존 방법으로는 검출하기 어려웠던 예상치 못한 희귀 병원균이나 새로운 변종까지 발견할 가능성을 열어줍니다. 또한, 유전체 정보를 분석하여 항생제 내성 관련 유전자들을 포괄적으로 확인하고 독력 인자(virulence factor) 등을 예측하여 환자의 예후나 맞춤형 치료 전략 수립에도 도움을 줄 수 있습니다. 마치 한 권의 책에서 특정 단어 몇 개만 찾는 것이 아니라, 책 전체 내용을 스캔하여 모든 정보를 파악하는 것과 같다고 비유할 수 있습니다.
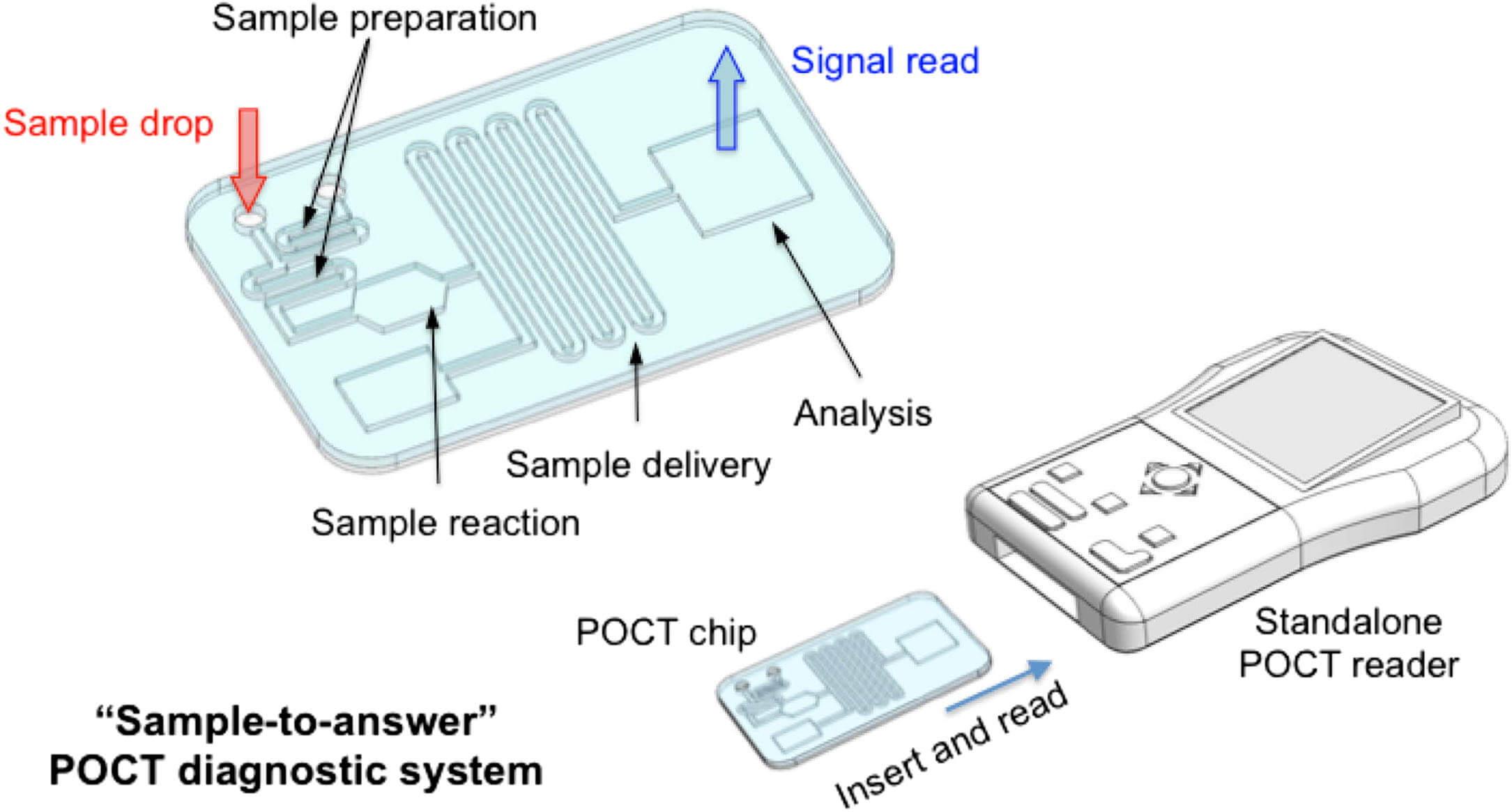
또 다른 유망한 접근법은 '미세유체칩(Microfluidics)' 기술을 기반으로 한 현장 진단(Point-of-Care Testing, POCT) 플랫폼 개발입니다. 미세유체칩은 아주 작은 채널과 챔버로 구성된 손톱만 한 크기의 칩 위에서 검체의 전처리, 미생물 분리, 배양(필요시 초단시간), 동정, 항생제 감수성 검사까지 모든 과정을 자동으로 통합하여 수행하는 기술입니다 [21]. 이를 통해 검사실로 검체를 운송하고 복잡한 장비를 사용하는 대신, 환자가 있는 곳(병실, 응급실, 심지어 가정)에서 소량의 검체만으로 몇 시간 안에 진단 결과를 얻는 것을 목표로 합니다. 마치 휴대용 혈당 측정기처럼 감염병 진단도 간편하고 신속하게 이루어질 수 있는 미래를 꿈꾸는 것이지요.
이러한 첨단 기술들이 발전함에 따라 배양 검사의 역할이 점차 축소될 것이라는 예측도 있습니다. 특히 신속성이 중요하거나 배양이 어려운 미생물 진단 영역에서는 비배양적 방법(분자 진단, NGS 등)이 더욱 중요해질 것입니다.
와, 그럼 이제 진짜 배양 검사는 구시대 유물이 되는 거 아냐? 병원 가서 지긋지긋하게 결과 기다릴 필요 없어지겠네!
매우 흥미로운 미래상이지만, 아직 그렇게 단정하기는 이릅니다. 많은 전문가들은 향후에도 상당 기간 동안 미생물 배양이 감염병 진단에서 중요한 역할을 계속 수행할 것이라고 예측합니다. 왜 그럴까요? 몇 가지 중요한 이유가 있습니다.
첫째, 배양은 '살아있는 미생물'을 확인하는 가장 확실한 방법입니다. 앞서 언급했듯이 분자 진단 검사는 유전 물질만 검출하기 때문에 살아있는 균과 죽은 균을 구별하기 어렵습니다. 하지만 배양은 실제로 증식 능력이 있는, 즉 감염을 일으킬 수 있는 살아있는 원인균의 존재를 직접적으로 증명해 줍니다. 이는 치료 효과를 판정하거나 감염과 단순 집락 상태를 구별하는 데 여전히 중요한 의미를 가집니다.
둘째, 현재로서는 '항생제 감수성 검사(Antibiotic Susceptibility Testing, AST)'를 가장 정확하고 포괄적으로 수행할 수 있는 방법이 배양 기반 검사입니다. 물론 유전자 분석을 통해 일부 내성 유전자를 예측할 수는 있지만, 실제 균이 다양한 항생제에 대해 어떤 반응(감수성, 중간 내성, 완전 내성)을 보이는지를 종합적으로 확인하려면 배양된 균을 이용하여 표준화된 방법으로 검사하는 것이 '표준(gold standard)'입니다. 특히 새로운 항생제나 복합적인 내성 기전에 대한 평가에는 배양 기반 검사가 필수적입니다. 효과적인 항생제 선택은 치료 성공과 항생제 내성 확산 방지에 매우 중요하므로, 이 부분에서 배양의 역할은 쉽게 대체되기 어렵습니다.
셋째, 배양은 '예상치 못한 병원균'을 발견할 수 있는 열린 가능성을 제공합니다. 분자 진단 패널이나 NGS 분석 파이프라인은 기본적으로 알려진 미생물이나 유전 정보를 기반으로 합니다. 하지만 배양은 특정 타겟 없이도 검체 내에 존재하는 다양한 미생물들이 자라날 수 있는 기회를 제공하며, 이를 통해 드물거나 새로운 병원균을 우연히 발견하게 될 수도 있습니다.
넷째, 배양을 통해 얻어진 실제 균주(isolate)는 역학 조사, 백신 개발, 새로운 진단법/치료법 연구 등 공중 보건 및 연구 목적에 매우 중요한 자원이 됩니다. 특정 지역이나 시기에 유행하는 균의 특성을 분석하거나, 새로운 항생제 내성 패턴의 출현을 감시하는 데 실제 균주 확보는 필수적입니다.
따라서 미래의 미생물 진단은 어느 한 가지 방법이 다른 방법을 완전히 대체하기보다는, 다양한 기술들이 서로의 장단점을 보완하며 함께 활용되는 방향으로 나아갈 가능성이 높습니다. 예를 들어, 응급 상황에서는 신속한 분자 진단 패널 검사로 초기 대응을 하고, 동시에 배양 검사를 진행하여 확진 및 항생제 감수성 정보를 확보하는 방식입니다. 또는 NGS 분석 결과 특이한 미생물이 의심될 경우, 배양을 통해 실제 균주를 분리하여 추가 연구를 진행할 수도 있습니다. 결국, 가장 중요한 것은 환자의 임상 상태와 검사의 특성을 종합적으로 고려하여 가장 적절하고 효율적인 진단 전략을 선택하는 것입니다.
결론적으로, 배양 없는 진단의 시대가 완전히 도래했다고 말하기는 아직 이르며, 미생물 배양은 앞으로도 감염병 진단과 연구에 있어 중요한 역할을 계속 수행할 것입니다. 물론 신속하고 정확한 진단을 위한 기술 개발은 끊임없이 이루어질 것이며, 이러한 발전은 환자 치료 결과를 개선하고 의료 시스템의 효율성을 높이는 데 크게 기여할 것입니다. 중요한 것은 새로운 기술의 가능성과 함께 기존 방법의 가치를 올바르게 이해하고, 이들을 조화롭게 활용하는 지혜일 것입니다.
기다림 속에 숨겨진 과학, 정확한 진단을 향한 여정
이번 시간에는 미생물 검체 종류별 배양 기간이라는 주제를 통해, 눈에 보이지 않는 작은 생명체들의 세계와 감염병 진단의 복잡하고도 정교한 과정에 대해 깊이 있게 탐구해 보았습니다. 우리는 병원에서 검사 결과를 기다리는 시간이 때로는 답답하고 지루하게 느껴질 수 있지만, 그 기다림 속에는 분명한 과학적 이유와 원리가 숨어 있음을 확인했습니다.
미생물 배양은 감염병의 원인균을 정확히 찾아내고 그에 맞는 최적의 치료법을 결정하기 위한 필수적인 과정입니다. 이 과정은 마치 씨앗을 심어 작물을 키우듯, 검체 속 미생물에게 적절한 영양분(배지)과 환경(온도, 산소 등)을 제공하여 충분히 증식시키는 것을 목표로 합니다. 미생물은 유도기, 대수기, 정지기, 사멸기라는 특징적인 성장 곡선을 그리며 자라나며, 이 중 대수기에 나타나는 세대 시간(수가 두 배로 늘어나는 데 걸리는 시간)의 차이가 미생물마다 성장 속도가 다른 근본적인 이유임을 배웠습니다.
이러한 기본 원리를 바탕으로, 우리는 다양한 검체 종류별로 왜 표준 배양 기간이 다른지 구체적인 사례들을 통해 살펴보았습니다.
- 혈액 배양(표준 5일): 패혈증 진단의 핵심으로, 혈액 내 극소량의 미생물을 증폭시켜야 하고, 느리게 자라는 균이나 항생제 영향을 고려하여 비교적 긴 시간이 필요합니다.
- 소변 배양(표준 18-24시간): 요로 감염 진단에 사용되며, 비교적 균 수가 많고 주 원인균(대장균 등)의 성장 속도가 빨라 결과 확인이 빠릅니다. 정량 배양으로 유의미한 균 수를 확인하는 것이 중요합니다.
- 객담 및 호흡기 검체 배양(표준 48시간 이상): 폐렴 등 진단에 필요하며, 정상 세균총 오염이 심하고 일부 원인균의 성장이 느리거나 특수 조건이 필요하여 시간이 더 소요됩니다. 특히 결핵균(최대 6-8주)은 극도로 느리게 자랍니다.
- 대변 배양(표준 48-72시간): 세균성 장염 원인균을 찾기 위해, 압도적인 정상 세균총 속에서 병원균을 선별하기 위한 특수 배지와 조건이 필요하여 시간이 걸립니다.
- 뇌척수액(CSF) 배양(표준 48-72시간): 세균성 뇌수막염 진단의 응급 검사지만, 까다로운 영양 요구성 균과 잠재적 성장 지연 가능성을 고려하여 일정 기간 배양이 필요합니다.
- 진균 배양(표준 2-4주 이상): 곰팡이, 효모 등 진균은 세균보다 훨씬 느리게 자라고 형태학적 동정에 시간이 필요하여 매우 긴 배양 기간을 요구합니다.
- 혐기성 세균 배양(표준 5-7일): 산소를 싫어하는 혐기성균은 특수 조건이 필요하고 성장 속도가 느려 일반 세균 배양보다 시간이 더 걸립니다.
또한, 이러한 검체 종류 외에도 환자의 항생제 사용 여부, 검체 채취 및 처리의 적절성, 검사실의 품질 관리, 미생물 균주의 특성 등 다양한 요인들이 실제 배양 기간과 결과에 영향을 미칠 수 있음을 인지하는 것이 중요합니다.
물론, 과학 기술의 발전은 자동화 배양 시스템, MALDI-TOF MS, 분자 진단 검사(PCR), 차세대 염기서열 분석(NGS) 등 미생물 진단의 속도와 정확성을 획기적으로 향상시키는 혁신적인 방법들을 우리에게 선사했습니다. 이러한 신속 기술들은 특히 응급 상황에서 진단 시간을 단축하고 환자 치료에 큰 도움을 주고 있으며, 앞으로 그 중요성은 더욱 커질 것입니다.
하지만 살아있는 균의 확인, 포괄적인 항생제 감수성 정보 제공, 예상치 못한 병원균 발견 가능성, 연구 및 공중 보건 목적의 균주 확보 등 미생물 배양이 가진 고유한 가치와 중요성은 여전히 유효합니다. 따라서 미래의 감염병 진단은 어느 한 가지 방법이 아니라, 전통적인 배양법과 혁신적인 신속 기술들이 서로의 장점을 살려 상호 보완적으로 활용되는 방향으로 나아갈 것입니다.
결론적으로, 미생물 검체 종류별 배양 기간의 차이는 각 검사의 목적, 검체의 특성, 그리고 대상 미생물의 생물학적 속성에 기반한 과학적인 필연성입니다. 단순히 결과가 빨리 나오는 검사가 항상 더 좋은 검사는 아니며, 때로는 정확한 진단을 위한 기다림이 환자의 건강을 위해 무엇보다 중요할 수 있습니다. 이 글을 통해 미생물 배양 검사에 대한 막연한 궁금증이 해소되고, 보이지 않는 곳에서 우리의 건강을 지키기 위해 노력하는 의료 및 검사실 전문가들의 수고를 조금이나마 이해하는 계기가 되었기를 바랍니다.
| 검체 종류 | 표준 배양 기간 (일반 세균 기준) | 주요 고려 사항 | 흔히 사용되는 배지 예시 |
|---|---|---|---|
| 혈액 (Blood) | 5일 | 패혈증 진단, 균 수 매우 적을 수 있음, 느린 균/항생제 영향 고려, 자동화 시스템 | 혈액 배양 병 (호기성/혐기성, 항생제 제거 수지 포함 가능) |
| 소변 (Urine) | 18-24시간 (최대 48시간) | 요로 감염 진단, 정량 배양 중요 (유의미한 세균뇨), 오염 주의, 주 원인균 빠름 | Blood agar, MacConkey agar |
| 객담 (Sputum) | 48시간 (결핵/진균 제외) | 호흡기 감염 진단, 정상 세균총 오염 심함, 검체 질 평가, 일부 균 느림/까다로움 | Blood agar, Chocolate agar, MacConkey agar |
| 대변 (Stool) | 48-72시간 | 세균성 장염 진단, 정상 세균총 극심, 선택/감별/증균 배지 필수, 캠필로박터 조건 | MacConkey, SS, XLD, Campy agar, Selenite broth 등 |
| 뇌척수액 (CSF) | 48-72시간 | 세균성 뇌수막염 진단 (응급), 무균 검체, 까다로운 균 고려 (초콜릿 배지 필수) | Blood agar, Chocolate agar, Thioglycollate broth |
| 진균 검체 | 2-4주 이상 | 진균 감염 진단, 매우 느린 성장, 형태학적 동정 중요, 특수 배지/온도 필요 | Sabouraud Dextrose Agar (SDA) |
| 혐기성 검체 | 5-7일 | 혐기성 감염 진단, 산소 노출 절대 금지, 특수 채취/운송/배양 환경, 느린 성장 | Brucella agar, Thioglycollate broth |
| 결핵균 검체 (객담 등) | 6-8주 (액체/고체 배지) | 결핵 진단, 극도로 느린 성장, 특수 전처리 및 배지 필요 | MGIT (액체), Ogawa/LJ (고체) |
2025.04.13 - [분자진단] - Pyrosequencing 의 원리와 방법, 적용 분야
Pyrosequencing 의 원리와 방법, 적용 분야
혹시 SF 영화 속에서 복잡한 기계가 순식간에 생명체의 유전 정보를 해독하는 장면을 보신 적이 있으신가요? 현실에서는 조금 더 복잡하지만, DNA 염기서열을 빠르고 정확하게 분석하는 기술은
labdoctor.tistory.com
2025.04.15 - [AI - IT] - 구글에서 공개한 프롬프트 엔지니어링 가이드 문서 완벽 정리!
구글에서 공개한 프롬프트 엔지니어링 가이드 문서 완벽 정리!
며칠 전 구글에서 제시한 프롬프트 엔지니어링에 관한 엄청난 소개 자료가 공개되어 많은 사람들에게 인기를 끌었습니다프롬프트 엔지니어링의 알파와 오메가바로 이 자료 인데요, 프롬프트
labdoctor.tistory.com
2025.04.15 - [임상화학] - 모세관 전기영동법 (Capillary electrophoresis)의 원리와 방법, 적용 분야
모세관 전기영동법 (Capillary electrophoresis)의 원리와 방법, 적용 분야
모세관 전기영동법(Capillary Electrophoresis, CE)을 혹시 들어보셨나요? 아마 생소하게 느끼시는 분들이 많을 것입니다. 하지만 분석화학, 특히 생화학이나 제약 분야에서는 매우 중요하고 강력한 분
labdoctor.tistory.com
2025.04.13 - [분자진단] - NGS (Next Generation Sequencing)의 개념, 원리, 방법, 적용 분야
NGS (Next Generation Sequencing)의 개념, 원리, 방법, 적용 분야
이번 시간에는 현대 생명과학과 의학 연구의 패러다임을 바꾼 혁신적인 기술, 차세대 염기서열 분석(Next Generation Sequencing, NGS)에 대해 심도 있게 알아보겠습니다. 혹시 몇 년 전, 유명 할리우드
labdoctor.tistory.com
참고문헌
- Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-810.
- Lee A, Mirrett S, Reller LB, Weinstein MP. Detection of bloodstream infections in adults: how many blood cultures are needed?. J Clin Microbiol. 2007;45(11):3546-3548.
- Riedel S, Bourbeau P, Swartz B, et al. Timing of specimen collection for blood cultures from febrile patients with bacteremia. J Clin Microbiol. 2008;46(4):1381-1385.
- Clinical and Laboratory Standards Institute (CLSI). Principles and Procedures for Blood Cultures; Approved Guideline. CLSI document M47-A. Wayne, PA: CLSI; 2007.
- Hall KK, Lyman JA. Updated review of blood culture contamination. Clin Microbiol Rev. 2006;19(4):788-802.
- Schmiemann G, Kniehl E, Gebhardt K, Matejczyk MM, Hummers-Pradier E. The diagnosis of urinary tract infection: a systematic review. Dtsch Arztebl Int. 2010;107(21):361-367.
- Murray PR, Washington JA. Microscopic and bacteriologic analysis of expectorated sputum. Mayo Clin Proc. 1975;50(6):339-344.
- World Health Organization (WHO). Treatment of tuberculosis: guidelines. 4th ed. Geneva: WHO; 2010.
- Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol. 2016;14(8):e1002533.
- van de Beek D, de Gans J, Spanjaard L, Weisfelt M, Reitsma JB, Vermeulen M. Clinical features and prognostic factors in adults with bacterial meningitis. N Engl J Med. 2004;351(18):1849-1859.
- Tunkel AR, Hartman BJ, Kaplan SL, et al. Practice guidelines for the management of bacterial meningitis. Clin Infect Dis. 2004;39(9):1267-1284.
- Leber AL, Everhart K, Balada-Llasat JM, et al. Multicenter Evaluation of BioFire FilmArray Meningitis/Encephalitis Panel for Detection of Bacteria, Viruses, and Yeast in Cerebrospinal Fluid Specimens. J Clin Microbiol. 2016;54(9):2251-2261.
- Bille J, Edson RS, Roberts GD. Clinical evaluation of the BACTEC radiometric system for recovery of yeasts and filamentous fungi from blood. J Clin Microbiol. 1984;20(1):14-18.
- Thompson GR 3rd, Wiederhold NP, Vallabhaneni S, et al. Advancements in the diagnosis of invasive fungal infections. Med Mycol. 2019;57(Supplement_2):S167-S174.
- Clinical and Laboratory Standards Institute (CLSI). Methods for Antimicrobial Susceptibility Testing of Anaerobic Bacteria; Approved Standard—Eighth Edition. CLSI document M11-A8. Wayne, PA: CLSI; 2012.
- Cockerill FR 3rd, Wilson JW, Vetter EA, et al. Optimal testing parameters for blood cultures. Clin Infect Dis. 2004;38(12):1724-1730.
- Baron EJ, Miller JM, Weinstein MP, et al. A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2013 recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM). Clin Infect Dis. 2013;57(4):e22-e121.
- Seng P, Drancourt M, Gouriet F, et al. Ongoing revolution in bacteriology: routine identification of bacteria by matrix-assisted laser desorption ionization time-of-flight mass spectrometry. Clin Infect Dis. 2009;49(4):543-551.
- Messacar K, Hurst AL, Child J, et al. Clinical Impact and Provider Acceptability of Real-Time Multiplex PCR Testing for Acute Respiratory Illness in Children. J Pediatric Infect Dis Soc. 2016;5(2):193-201.
- Chiu CY, Miller SA. Clinical metagenomics. Nat Rev Genet. 2019;20(6):341-355.
- Schoepp NG, Schlappi TS, Sugiarto S, et al. Rapid pathogen-specific phenotypic antibiotic susceptibility testing using digital LAMP quantification in clinical samples. Sci Transl Med. 2017;9(410):eaal3693.
'임상미생물' 카테고리의 다른 글
| 정맥내 카테터 연관 혈류 감염증의 진단 기준과 방법 (1) | 2025.04.20 |
|---|---|
| 혈액 배양시 오염균 판정 기준 (1) | 2025.04.20 |
| 검체 종류에 따른 세균 접종 및 배양 배지와 동정법 (0) | 2025.04.17 |
| 호기성, 혐기성 균종에 따른 배양 환경과 방법 (1) | 2025.04.17 |
| 세균배양검사를 위한 배지의 종류 (0) | 2025.04.17 |




댓글