수혈의 안전성은 현대 의학의 초석 중 하나이며, 이 안전성을 담보하는 핵심적인 과정이 바로 혈액은행 검사실에서 수행되는 정밀한 수혈 전 검사들입니다. 환자와 공여자 혈액 간의 적합성을 확인하기 위한 ABO/RhD 혈액형 검사, 예상치 못한 항체의 존재 유무를 확인하는 항체 선별 및 동정 검사, 그리고 최종적으로 수혈될 혈액과 환자 혈액 간의 반응을 미리 살펴보는 교차시험(Crossmatch) 등은 모두 한 치의 오차도 용납되지 않는 매우 중요한 검사들입니다. 과거 이러한 검사들은 대부분 시험관을 이용한 수기법(Manual tube testing)에 의존했지만, 검사량의 증가, 표준화의 필요성, 그리고 결과 판독의 객관성 확보 요구에 따라 자동화 및 반자동화된 검사법들이 개발되어 널리 사용되고 있습니다.
그중에서도 현재 전 세계적으로 가장 대표적으로 사용되는 두 가지 주요 검사 플랫폼이 바로 '컬럼 응집법(Column Agglutination Technology, CAT)'과 '마이크로플레이트법(Microplate Method)'입니다. 이 두 방법은 시험관법의 한계를 극복하고 검사실의 효율성과 정확성을 크게 향상시켰지만, 각각 고유한 작동 원리, 수행 절차, 그리고 장단점을 가지고 있습니다.
아, 그럼 요즘 병원에서는 시험관으로 하나하나 검사하는 게 아니라, 이런 다른 방법들을 주로 쓴다는 말씀이시군요? 컬럼? 마이크로플레이트? 이름만 들어서는 어떤 방식인지 전혀 감이 안 오는데요. 이 둘은 어떻게 다르고, 어떤 게 더 좋은 건가요?
네, 맞습니다. 현재 많은 중대형 병원의 혈액은행에서는 검사의 효율성과 표준화를 위해 이 두 가지 방법 중 하나 또는 둘 모두를 활발하게 사용하고 있습니다. 이름만으로는 생소하게 들릴 수 있지만, 각각의 방법은 매우 독창적인 원리를 바탕으로 항원-항체 반응을 시각화하고 판독합니다. "어떤 것이 더 좋다"라고 단정하기는 어렵습니다. 왜냐하면 각 방법의 장단점이 뚜렷하여, 검사실의 환경(예: 검사량, 예산, 인력 구성)과 목적에 따라 더 적합한 방법이 선택되기 때문입니다.
이번 시간에는 혈액은행 검사의 두 가지 핵심 자동화 플랫폼인 컬럼 응집법과 마이크로플레이트법에 대해, 각각의 근본적인 작동 원리는 무엇인지, 실제 검사가 어떤 절차를 통해 이루어지는지, 그리고 임상 검사실 환경에서 각 방법이 가지는 장점과 단점은 무엇인지에 대해 이전보다 훨씬 더 깊이 있고, 상세하며, 체계적으로 비교 분석해 보도록 하겠습니다. 이 두 방법의 차이를 명확히 이해하는 것은 혈액은행 검사의 신뢰성과 효율성을 평가하는 데 중요한 기초가 될 것입니다.
컬럼 응집 기술 (Column Agglutination Technology, CAT): 미세 기둥 속 겔 또는 비드의 여과 원리
컬럼 응집 기술(Column Agglutination Technology, CAT), 종종 '겔 카드(Gel Card)' 또는 '비드 컬럼(Bead Column)' 기술이라고도 불리는 이 방법은, 1980년대 후반 Dr. Yves Lapierre에 의해 개발된 혁신적인 면역혈액학적 검사 기법입니다. 이 기술의 핵심은 미세한 기둥(microtube 또는 column) 내부에 특수한 매트릭스(matrix) 물질, 즉 겔(gel)이나 유리 구슬(glass beads)이 채워져 있다는 것입니다. 그리고 이 매트릭스는 항원-항체 반응의 결과를 판독하는 독특한 '필터' 역할을 수행합니다.
컬럼 응집법의 작동 원리
컬럼 응집법의 기본 원리는 '크기 배제 크로마토그래피(Size Exclusion Chromatography)' 또는 '겔 여과(Gel Filtration)'의 원리와 매우 유사합니다. 각 미세 기둥(microtube) 안에는 항글로불린 시약(Anti-IgG 등)이나 중성 겔(Neutral gel) 등 특정 시약이 미리 포함된 겔(주로 Sephadex 겔) 또는 미세 유리 구슬(glass beads) 매트릭스가 채워져 있습니다.
이 매트릭스는 미세한 다공성 구조를 가지고 있어, 마치 정교한 체(sieve)와 같은 역할을 합니다. 검사가 시작되면, 환자의 적혈구 현탁액과 혈청(또는 혈장)이 미세 기둥 상단의 반응 챔버(reaction chamber)에 분주됩니다. 만약 환자의 혈청 내에 적혈구 항원에 대한 항체가 존재하거나, 또는 적혈구가 이미 항체로 코팅되어 있는 경우(DAT 검사 시), 적혈구와 항체가 반응하여 응집괴(agglutinates)를 형성하게 됩니다. 그 후, 이 카드를 특수 설계된 원심분리기(card centrifuge)에 넣고 원심분리를 시행합니다.
원심분리 과정에서 발생하는 원심력은 적혈구들을 미세 기둥 내의 겔 또는 비드 매트릭스를 통과하도록 아래쪽으로 밀어냅니다. 이때, 크기가 큰 적혈구 응집괴(agglutinates)는 겔 또는 비드 매트릭스의 미세한 구멍(pore)을 통과하지 못하고 매트릭스 상층부나 중간층에 걸리게(trapped) 됩니다. 반면, 응집이 일어나지 않은 개개의 자유 적혈구(unagglutinated red cells)는 크기가 작기 때문에 매트릭스의 구멍 사이를 비교적 자유롭게 통과하여 미세 기둥의 가장 아래쪽 바닥까지 이동하여 침전됩니다.
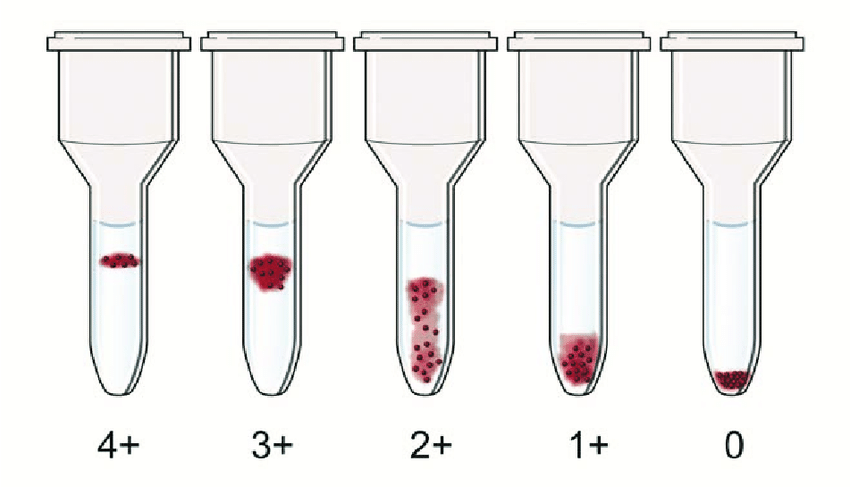
따라서, 원심분리 후 미세 기둥 내 적혈구의 최종 위치를 관찰함으로써 항원-항체 반응의 유무 및 강도를 판독할 수 있습니다. 강한 양성 반응 (Strong Positive, 예: 4+)은 큰 응집괴가 형성되어 겔/비드 매트릭스 상단 표면에 붉은 선 또는 덩어리 형태로 걸려 있는 모습으로 나타납니다. 다양한 강도의 양성 반응 (Positive, 예: 3+, 2+, 1+)은 응집괴의 크기와 분포에 따라, 적혈구들이 매트릭스 상층부에서 중간층까지 다양한 높이에 걸쳐 분산되어 분포하는 양상을 보이며, 반응이 약할수록 더 아래쪽까지 내려옵니다. **
음성 반응 (Negative, 0)은 응집이 전혀 일어나지 않아 모든 적혈구가 매트릭스를 통과하여 미세 기둥의 가장 아래쪽 바닥에 선명하고 작은 붉은 점(pellet) 형태로 침전되어 있는 상태입니다. 혼합시야 반응 (Mixed-Field Reaction)은** 응집된 적혈구 덩어리가 겔 상층부에 걸려 있으면서 동시에 응집되지 않은 일부 적혈구가 기둥 바닥에 침전되어 있는 독특한 양상으로 관찰되며, 이는 두 종류 이상의 적혈구 집단이 혼재되어 있거나(예: 수혈 후), 특정 혈액형 아형(예: A3) 등에서 나타날 수 있습니다.
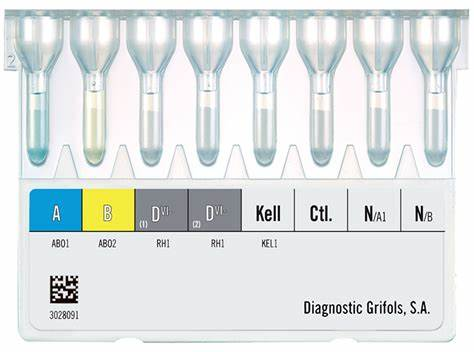
컬럼 내에는 검사 목적에 따라 다양한 시약이 미리 포함될 수 있습니다. 예를 들어, ABO 혈구형 검사용 컬럼에는 Anti-A, Anti-B 시약이 각각 포함된 겔이, RhD 검사용 컬럼에는 Anti-D 시약이, 그리고 항체 선별/동정 및 교차시험과 같은 간접 항글로불린 검사(Indirect Antiglobulin Test, IAT)용 컬럼에는 Anti-IgG 항체(때로는 Anti-C3d 혼합)가 포함된 겔이 미리 분주되어 있습니다. 이를 통해 IAT 검사 시 시험관법에서 필수적이었던 여러 번의 세척(washing) 과정을 생략할 수 있다는 큰 장점을 가집니다. 원심분리 과정에서 혈청 단백질은 겔을 통과하고, 항체로 감작된 적혈구만 Anti-IgG와 반응하여 겔에 걸리게 되는 원리입니다.
컬럼 응집법의 검사 절차
컬럼 응집법을 이용한 검사는 일반적으로 다음과 같은 단계로 진행되며, 많은 부분이 자동화 장비에 의해 수행될 수 있습니다. 먼저, 검체 및 시약을 준비하는 단계입니다. 환자의 혈액 검체로부터 혈청 또는 혈장, 그리고 적혈구를 분리합니다. 적혈구는 특정 농도(예: 0.8% 또는 1%)의 저이온강도 용액(Low Ionic Strength Solution, LISS)이나 다른 희석액에 부유시켜 적혈구 현탁액을 만듭니다. 검사에 필요한 컬럼 카드(gel card or bead card)와 표준 시약 적혈구(screening cells, panel cells) 등도 준비합니다.
다음은 분주(Dispensing) 단계로, 자동화 장비 또는 수동 파이펫을 이용하여 준비된 환자 적혈구 현탁액과 혈청(또는 혈장), 그리고 필요한 경우 표준 시약 적혈구를 컬럼 카드 상단의 반응 챔버 또는 웰(well)에 정확한 양만큼 분주합니다. 각 미세 기둥은 특정 검사(예: Anti-A, Anti-B, Anti-D, Anti-IgG 등)에 해당하도록 미리 설정되어 있습니다.
이후 배양(Incubation) 단계가 필요한 경우가 있습니다. 간접 항글로불린 검사(IAT)가 요구되는 항체 선별, 항체 동정, 교차시험 등의 경우에는, 항원-항체 반응이 충분히 일어날 수 있도록 카드를 특정 온도(보통 37℃)에서 일정 시간(예: 15분) 동안 배양하는 과정이 필요합니다. ABO/RhD 혈구형 검사나 직접 항글로불린 검사(DAT)의 경우에는 이 배양 단계가 생략될 수 있습니다.
배양이 완료된 (또는 배양이 필요 없는) 컬럼 카드는 원심분리(Centrifugation) 단계를 거칩니다. 카드를 컬럼 응집법 전용 원심분리기에 넣고 정해진 속도와 시간(예: 약 10분) 동안 원심분리를 시행하여 적혈구가 겔 또는 비드 매트릭스를 통과하도록 합니다. 마지막으로 판독 및 해석(Reading and Interpretation) 단계입니다. 원심분리가 완료된 컬럼 카드를 꺼내어 각 미세 기둥 내 적혈구의 분포 상태를 시각적으로 관찰하여 결과를 판독합니다.
앞서 설명한 기준에 따라 0 (음성)부터 4+ (강한 양성)까지의 등급으로 반응 강도를 기록하며, 혼합시야 반응 여부도 면밀히 확인합니다. 최근에는 자동화된 카드 판독기(automated card reader)가 카메라와 이미지 분석 소프트웨어를 이용하여 결과를 자동으로 판독하고 디지털화하여 기록하는 시스템이 널리 사용되어 판독의 객관성과 효율성을 더욱 높이고 있습니다.
컬럼 응집법의 장점
컬럼 응집 기술은 기존의 시험관법에 비해 여러 가지 뚜렷한 장점을 제공하며, 이것이 이 기술이 전 세계적으로 널리 채택된 이유입니다.
첫째로, 높은 민감도와 특이도를 장점으로 꼽을 수 있습니다. 겔 또는 비드 매트릭스의 독특한 구조는 약한 항원-항체 반응조차 효과적으로 검출할 수 있도록 도와주어 민감도(sensitivity)가 일반적으로 우수한 것으로 평가받습니다. 동시에, 응집괴와 비응집 적혈구를 물리적으로 명확하게 분리하는 원리는 위양성 반응의 가능성을 줄여 높은 특이도(specificity)를 보장하는 데 기여합니다.
둘째로, 검사 과정의 표준화 및 결과 판독의 객관성 향상이 두드러집니다. 미리 정해진 양의 시약이 분주된 카드를 사용하고, 정해진 프로토콜에 따라 원심분리 및 판독이 이루어지므로, 검사 과정 자체가 고도로 표준화되어 검사자 간의 변동성을 줄일 수 있습니다. 또한, 반응 결과가 겔이나 비드 매트릭스 내 적혈구의 최종 위치라는 명확하고 시각적인 형태로 나타나므로, 시험관법에서 응집 덩어리의 크기를 주관적으로 판단해야 했던 어려움에 비해 결과 판독의 객관성이 현저히 향상되었습니다. 특히 자동 판독 시스템을 도입할 경우, 이러한 객관성은 더욱 극대화될 수 있습니다.
셋째로, 반응 결과의 안정성이 뛰어나다는 장점이 있습니다. 반응이 완료된 컬럼 카드는 밀봉된 상태로 일정 기간 동안 안정적으로 보관될 수 있습니다. 이는 결과의 재확인이 필요하거나, 교육 및 품질 관리 목적으로 검토할 때 매우 유용하게 활용될 수 있습니다.
넷째로, 검체량 감소 효과를 들 수 있습니다. 전통적인 시험관법에 비해 상대적으로 적은 양의 환자 검체(적혈구, 혈청)와 시약을 사용하므로, 특히 검체 채취가 제한적인 소아 환자나 채혈이 어려운 환자의 경우에 매우 유리한 측면이 있습니다.
다섯째로, 사용 편의성 및 자동화 적합성이 높습니다. 검사 절차가 비교적 간편하며, 특히 간접 항글로불린 검사(IAT)에서의 여러 번에 걸친 세척 단계가 생략되어 전체적인 검사 시간을 단축하고 수작업 오류 가능성을 줄여줍니다. 또한, 카세트 형태의 디자인은 분주부터 판독까지 전체 과정을 자동화 시스템에 통합하기에 매우 용이한 플랫폼을 제공합니다.
마지막으로, IAT 세척 과정이 불필요하다는 점은 다시 한번 강조할 만한 큰 장점입니다. 컬럼 내에 Anti-IgG 시약이 미리 포함되어 있어, 항체 감작 반응 후 별도의 세척 과정 없이 바로 원심분리를 통해 결과를 얻을 수 있으므로, 시간과 노동력을 크게 절약하고 세척 불량으로 인한 잠재적인 오류 발생 가능성을 원천적으로 차단할 수 있습니다.
컬럼 응집법의 단점
물론, 컬럼 응집법에도 몇 가지 고려해야 할 단점 또는 기술적인 한계점들이 존재합니다.
첫째로, 비용적인 측면을 고려해야 합니다. 전통적인 시험관법에 비해 개별 검사에 사용되는 컬럼 카드 자체의 단가가 상대적으로 높으며, 검사를 수행하기 위한 전용 원심분리기, 배양기(필요시), 자동 판독기 등 초기 장비 도입 및 유지 보수 비용 또한 상당할 수 있습니다.
둘째로, 특수한 전용 장비가 요구된다는 점입니다. 일반적인 실험실용 원심분리기로는 컬럼 카드를 사용할 수 없으며, 반드시 컬럼 카드 규격에 맞게 설계된 전용 원심분리기가 필요합니다. 또한, 자동화 시스템을 구축하기 위해서는 추가적인 전용 장비들이 요구됩니다.
셋째로, 특정 검체 조건에서는 간섭 현상이 발생할 수 있습니다. 특히 혈장 검체를 사용하거나 항응고 처리가 불완전한 혈청 검체를 사용할 경우, 미세한 피브린(fibrin) 가닥이나 혈병(clot) 덩어리가 형성되어 원심분리 시 겔 매트릭스 상단에 걸리면서 마치 약한 양성 반응처럼 보이는 위양성(false positive) 결과를 초래할 수 있습니다. 따라서 검체 준비 및 확인 과정에서의 세심한 주의가 필요합니다.
넷째로, 일부 특수한 검사 수행에는 제한이 따를 수 있습니다. 매우 복잡한 항체 동정 문제 해결을 위한 특수 기법(예: 특정 온도에서의 반응성 상세 비교, 정밀한 역가 측정, 특수 효소 처리 등)을 적용하는 데 있어서는, 시험관법에 비해 실험 설계나 조작의 유연성이 다소 떨어질 수 있습니다.
다섯째로, 약한 반응 판독의 어려움이 여전히 존재할 수 있습니다. 비록 판독의 객관성이 크게 향상되었다고는 하지만, 매우 약한 양성 반응(예: 1+ 또는 w+)과 진정한 음성 반응(0)을 명확하게 구분하는 것이 때로는 여전히 어려울 수 있으며, 이러한 미묘한 차이를 판독하는 데에는 판독자의 경험과 숙련도가 중요하게 작용할 수 있습니다. 특히 혼합시야 반응의 정확한 판독과 해석은 여전히 주의를 요하는 부분입니다.
마이크로플레이트법 (Microplate Method) : 고효율 대량 검사를 위한 플랫폼
마이크로플레이트법(Microplate Method)은 주로 96개의 작은 우물(well)이 격자 형태로 배열된 표준 마이크로타이터 플레이트(microtiter plate)를 이용하여 다수의 검체를 동시에 처리하고 결과를 판독하는 방식의 검사법입니다. 이 방법은 특히 하루에 수백 건 이상의 대량 검체를 신속하고 효율적으로 처리해야 하는 대형 혈액원이나 병원 검사실에서 자동화 시스템과 긴밀하게 결합되어 널리 활용되고 있습니다. 마이크로플레이트법은 그 반응 원리에 따라 크게 액상법(liquid phase)과 고체상법(solid phase)이라는 두 가지 주요한 형태로 나눌 수 있습니다.

마이크로플레이트법의 작동 원리
액상 마이크로플레이트법 (Liquid Phase Microplate Method)
액상 마이크로플레이트법의 기본적인 반응 원리는 전통적인 시험관법과 매우 유사합니다. 즉, 마이크로플레이트의 각각의 작은 웰(주로 U자형 또는 V자형 바닥 모양을 가짐) 안에서 환자의 적혈구 현탁액과 혈청(또는 특정 항체 시약)을 혼합하여 항원-항체 반응이 일어나도록 유도합니다. 반응이 완료된 후 플레이트를 특정 조건(속도, 시간)으로 원심분리하면, 웰 바닥에서 적혈구가 침강하는 패턴을 관찰하여 응집(agglutination)의 유무와 강도를 판독하는 방식입니다.
음성 반응 (Negative)의 경우, 항원-항체 반응이 일어나지 않았기 때문에 개개의 적혈구 세포들은 원심력에 의해 웰 바닥의 가장 낮은 지점(U자나 V자의 꼭지점)으로 부드럽게 미끄러져 내려와 작고 둥글며 경계가 매우 뚜렷한 붉은색 점(button) 또는 펠렛(pellet) 형태로 단단하게 침전됩니다.
양성 반응 (Positive)의 경우, 항원-항체 반응에 의해 다양한 크기의 적혈구 응집괴(agglutinates)가 형성되면, 이 응집괴들은 웰의 경사진 벽면에 걸리거나 웰 바닥 전체에 넓게 퍼져 균일하거나 또는 불규칙한 얇은 막(mat) 또는 마치 카펫(carpet)처럼 깔린 듯한 형태로 나타나게 됩니다. 응집 반응이 강할수록(예: 4+) 적혈구는 더 넓은 면적에 걸쳐 균일하게 퍼지며, 약한 응집(예: 1+, 2+)은 웰 중앙의 버튼 주변에 희미한 헤일로(halo) 형태를 보이거나 버튼의 경계가 불명확해지고 가장자리가 거칠어지는 양상을 보입니다. 반응 강도는 이러한 버튼의 크기, 모양, 경계의 명확성, 그리고 적혈구가 퍼진 정도 등을 종합적으로 평가하여 0부터 4+까지의 등급으로 판정합니다.
액상 마이크로플레이트법을 이용하여 간접 항글로불린 검사(IAT)를 수행할 경우에는, 시험관법과 마찬가지로 여러 번의 세척 단계가 필수적으로 요구됩니다. 항체 감작을 위한 배양 단계가 끝난 후, 웰 내에 남아있는 결합하지 않은 혈청 단백질들(특히 과량의 면역글로불린)을 효과적으로 제거하기 위해, 각 웰에 생리식염수를 채우고 원심분리하여 상층액을 조심스럽게 버리는 과정을 자동화된 플레이트 세척기(automated plate washer)를 이용하여 보통 3~4회 반복 수행합니다. 이 철저한 세척 과정이 끝난 후에 최종적으로 항글로불린 시약(Anti-IgG 등)을 첨가하고 다시 원심분리하여 형성된 응집 패턴을 판독하게 됩니다.
고체상 적혈구 부착법 (Solid Phase Red Cell Adherence, SPRCA)

고체상법(Solid Phase)은 액상법과는 상당히 다른 독특한 원리에 기반한 검사법입니다. SPRCA 기법에서는 마이크로플레이트 웰의 바닥 표면에 특정 반응 물질(항원 또는 항체)이 미리 단단하게 코팅(coated) 또는 부착(adhered)되어 있다는 점이 핵심적인 차이입니다.
항체 선별/동정 검사 (SPRCA-IAT)의 경우, 웰 바닥에는 제조 과정에서 표준 적혈구 세포막에서 추출한 특정 항원(예: 항체 선별 검사용 세포의 주요 항원들)이 미리 고정(immobilized)되어 있습니다. 검사를 시작하면 이 웰에 환자의 혈청과 LISS(Low Ionic Strength Solution)와 같은 반응 증강제를 넣고 일정 시간 동안 배양합니다. 만약 환자 혈청 내에 웰 바닥에 코팅된 항원에 대한 항체가 존재한다면, 이 항체는 웰 바닥의 항원과 특이적으로 결합하게 됩니다.
이후 여러 번의 자동 세척 과정을 통해 결합하지 않은 혈청 단백질들을 깨끗하게 제거합니다. 마지막 단계로, Anti-IgG 항체로 미리 코팅된 특수한 지시 적혈구(indicator red cells)를 각 웰에 첨가하고 짧게 원심분리를 시행합니다. 만약 환자의 항체가 웰 바닥의 항원에 결합해 있었다면, 이 항체의 Fc 부분(항체의 꼬리 부분)에 지시 적혈구 표면의 Anti-IgG가 결합하게 되어, 결과적으로 지시 적혈구들이 웰 바닥 전체에 붉은색의 균일한 부착층(layer of adherence)을 형성하게 됩니다. 이것이 양성 반응입니다. 반대로, 만약 환자 혈청 내에 해당 항체가 없었다면, 지시 적혈구는 웰 바닥에 아무것에도 결합하지 못하고 원심력에 의해 웰 바닥 중앙에 작고 뚜렷한 버튼 형태로 모이게 됩니다. 이것이 음성 반응입니다.
적혈구 항원 검사 (SPRCA-Direct)의 경우에는 원리가 반대로 적용됩니다. 즉, 웰 바닥에는 특정 적혈구 항원에 대한 매우 특이적인 단클론성 항체(monoclonal antibody, 예: Anti-A, Anti-B, Anti-D)가 미리 코팅되어 있습니다. 여기에 환자의 적혈구 현탁액을 넣고 원심분리를 시행합니다. 만약 환자의 적혈구가 웰 바닥에 코팅된 항체에 해당하는 항원을 가지고 있다면, 적혈구는 이 항체와 결합하여 웰 바닥 전체에 균일한 붉은색 부착층을 형성하게 됩니다(양성 반응). 만약 환자 적혈구에 해당 항원이 없다면, 적혈구는 항체와 결합하지 못하고 원심력에 의해 웰 바닥 중앙에 작고 뚜렷한 버튼 형태로 모이게 됩니다(음성 반응).
SPRCA 기법은 일반적으로 액상법에 비해 반응 결과의 판독이 더 명확하고 민감도가 더 높다는 장점을 가질 수 있습니다. 하지만, 액상법과는 다른 종류의 비특이적 반응이나 간섭 요인(예: 혈청 내 과도한 단백질, 류마티스 인자 등)에 의해 영향을 받을 수 있으므로 결과 해석에 주의가 필요합니다.
2025.04.07 - [수혈의학] - ABO 혈액형 항원, 검사의 모든 것 - 구조, 유전, 표현형, 그리고 검사법
ABO 혈액형 항원, 검사의 모든 것 - 구조, 유전, 표현형, 그리고 검사법
혹시 수혈이 필요했던 경험이나, 주변 사람의 수혈 경험을 들어보신 적 있으신가요? 수혈은 생명을 살리는 중요한 의료 행위이지만, 아무 혈액이나 받을 수는 없습니다. 잘못된 혈액형의 피를
labdoctor.tistory.com
마이크로플레이트법의 검사 절차
마이크로플레이트법 검사 절차는 특히 대량 검체 처리를 위한 고도의 자동화 시스템에 매우 적합하게 설계되어 있습니다.
검사를 시작하기 위해 검체 및 시약을 준비합니다. 환자 검체(혈청/혈장, 적혈구 현탁액)와 검사에 필요한 다양한 시약들(표준 세포 현탁액, 항혈청 시약, LISS, 항글로불린 시약, SPRCA용 지시 세포 등)을 준비하여 자동화 장비에 장착합니다. 다음 분주(Dispensing) 단계에서는, 자동화된 액체 처리 로봇 팔(liquid handling robot arm)이 마이크로플레이트의 각 웰에 필요한 검체와 시약을 미리 설정된 프로그램에 따라 정해진 순서와 정확한 양만큼 자동으로 분주합니다.
이후, 검사의 종류에 따라 배양(Incubation) 단계가 필요할 수 있습니다. 특히 간접 항글로불린 검사(IAT)나 SPRCA-IAT의 경우, 항원-항체 반응이 충분히 일어날 수 있도록 플레이트를 특정 온도(보통 37℃)에서 일정 시간 동안 배양해야 합니다. 완전 자동화 시스템에서는 이러한 배양 과정이 장비 내부에 통합된 자동 배양기(incubator)에서 자동으로 이루어집니다.
배양(또는 배양이 필요 없는 경우 분주) 후에는 원심분리(Centrifugation) 단계를 거칩니다. 마이크로플레이트를 수용할 수 있도록 특수 설계된 마이크로플레이트 전용 원심분리기(microplate centrifuge)를 사용하여 정해진 속도와 시간 동안 원심분리를 수행하여 반응을 유도하거나 세포를 침전시킵니다.
세척(Washing) 단계는 주로 간접 항글로불린 검사(IAT) 및 SPRCA-IAT에서 필수적입니다. 항체 감작을 위한 배양 단계가 끝난 후, 그리고 항글로불린 시약이나 지시 적혈구를 첨가하기 전에, 자동 플레이트 세척기(automated plate washer)를 이용하여 각 웰 내부를 여러 번(보통 3-4회) 생리식염수로 채우고 상층액을 흡입하여 제거하는 과정을 반복함으로써 결합하지 않은 단백질들을 효과적으로 제거합니다. SPRCA-IAT에서도 항체 결합 후 지시 적혈구 첨가 전에 세척 과정이 필수적입니다.
세척 과정 후에 필요한 경우 추가 시약을 첨가합니다. 예를 들어, IAT 검사에서는 항글로불린 시약을, SPRCA-IAT 검사에서는 지시 적혈구를 각 웰에 첨가합니다.
마지막으로, 최종 반응을 유도하기 위해 다시 짧게 최종 원심분리를 시행한 후, 결과를 판독하고 해석(Reading and Interpretation)합니다. 판독은 두 가지 방식으로 이루어질 수 있습니다. 하나는 숙련된 검사자가 플레이트를 특정 각도로 기울여 보면서 각 웰 바닥에 형성된 적혈구의 패턴(뚜렷한 버튼 형태 또는 부착/분산된 형태)을 직접 눈으로 관찰하여 반응 강도를 0부터 4+까지의 등급으로 매기는 전통적인 수동 판독(manual reading) 방식입니다.
다른 하나는 고해상도 CCD 카메라와 정교한 이미지 분석 소프트웨어가 장착된 자동 마이크로플레이트 판독기(automated microplate reader)를 이용하여 각 웰의 이미지를 촬영하고 분석하여 결과를 객관적으로 판독하고 그 결과를 디지털 데이터로 자동 저장하는 자동 판독(automated reading) 방식입니다. 자동 판독 방식은 판독의 주관성을 배제하고 대량의 결과를 신속하게 처리하며 데이터 관리를 용이하게 한다는 큰 장점을 제공합니다.
마이크로플레이트법의 장점
마이크로플레이트법은 특히 대규모 검사실 환경에서 검사 효율성과 자동화 측면에서 여러 가지 강력한 장점들을 제공합니다.
가장 큰 장점은 바로 높은 처리량(High Throughput)과 자동화 적합성입니다. 표준화된 96웰 마이크로플레이트 형식은 로봇 시스템을 이용한 대규모 자동화 공정을 설계하고 구현하는 데 매우 이상적인 플랫폼을 제공합니다. 이를 통해 한 번에 수십 또는 수백 개의 검체를 동시에 자동으로 처리할 수 있어 검사 처리 속도가 매우 빠르며, 검사실의 전반적인 생산성을 크게 향상시킬 수 있습니다.
비용 효율성 측면에서도 장점을 가질 수 있습니다. 비록 초기 자동화 장비 도입 비용은 상당할 수 있지만, 일단 시스템이 구축되면 전통적인 시험관법이나 컬럼 응집법에 비해 개별 검사 하나를 수행하는 데 소요되는 시약 및 소모품(주로 마이크로플레이트)의 비용이 상대적으로 저렴할 수 있습니다. 특히 처리하는 검체량이 매우 많은 대형 검사실의 경우, 이러한 규모의 경제(economy of scale) 효과는 더욱 커질 수 있습니다.
자동화 시스템을 사용할 경우, 검사 과정의 표준화 수준이 매우 높아집니다. 분주, 배양, 세척, 원심분리, 판독 등 검사의 모든 단계가 미리 설정된 프로토콜에 따라 로봇에 의해 정확하고 일관되게 수행되므로, 수작업에서 발생할 수 있는 오류나 검사자 간의 변동성을 최소화하고 항상 일관성 있는 결과를 얻는 데 유리합니다.
검체 및 시약 사용량 감소 역시 중요한 장점입니다. 전통적인 시험관법과 비교했을 때, 마이크로플레이트법은 훨씬 적은 양의 환자 검체(혈청/혈장, 적혈구)와 고가의 시약을 사용하므로, 검체 확보가 어렵거나 시약 비용을 절감해야 하는 상황에서 유리할 수 있습니다.
마지막으로, 데이터 관리의 용이성을 들 수 있습니다. 자동 판독 시스템을 사용하는 경우, 모든 검사 결과가 자동으로 디지털 데이터 형태로 생성되고 저장되므로, 검사실 정보 시스템(Laboratory Information System, LIS)과의 연동이 매우 용이하며, 결과 보고, 통계 처리, 품질 관리 데이터 추적 등 데이터 관리 업무의 효율성을 크게 향상시킬 수 있습니다.
마이크로플레이트법의 단점
물론, 마이크로플레이트법 역시 몇 가지 본질적인 단점과 기술적으로 고려해야 할 사항들을 가지고 있습니다.
가장 흔히 지적되는 단점 중 하나는 결과 판독의 주관성 문제, 특히 수동 판독 시에 발생할 수 있다는 점입니다. 액상 마이크로플레이트법에서 웰 바닥에 형성된 적혈구 버튼의 모양, 크기, 경계의 명확성이나 주변부로 퍼진 정도를 정확하게 판독하고 등급을 매기는 것은 컬럼 응집법의 명확한 분리 패턴에 비해 다소 주관적일 수 있으며, 특히 매우 약한 응집 반응(weak reaction)의 해석에는 판독자의 숙련된 경험과 일관성이 매우 중요하게 작용합니다. 또한, 플레이트를 관찰하는 각도나 조명 조건 등 외부 요인에 따라서도 결과가 다르게 보일 수 있는 가능성이 있습니다. (단, 자동 판독 시스템은 이러한 주관성을 크게 줄여줄 수 있습니다.)
간접 항글로불린 검사(IAT) 시 필수적인 세척 단계의 중요성과 잠재적인 문제점도 고려해야 합니다. IAT의 정확성을 위해서는 여러 번의 세척 과정을 통해 결합하지 않은 항체를 완벽하게 제거하는 것이 매우 중요하지만, 이 세척 과정이 불완전할 경우에는 항글로불린 시약이 중화되어 위음성(false negative) 결과를 초래하거나, 반대로 비특이적인 단백질이 남아서 위양성(false positive) 결과를 유발할 수도 있습니다. 또한, 반복적인 세척 및 상층액 제거 과정에서 미량의 적혈구 세포가 소실될 수도 있으며, 자동 세척 장비의 정밀한 작동과 정기적인 유지 관리가 결과의 신뢰성을 유지하는 데 매우 중요합니다.
프로존 현상(Prozone Effect)의 발생 가능성도 염두에 두어야 합니다. 환자의 혈청 내에 특정 항체의 농도가 비정상적으로 매우 높을 경우, 오히려 항원 과잉 상태와 유사한 상황이 되어 항원-항체 간의 적절한 격자 형성(lattice formation)이 방해를 받아, 예상보다 응집 반응이 약하게 나타나거나 심지어 위음성 결과를 보이는 프로존 현상이 발생할 수 있습니다. 이러한 현상은 시험관법보다 마이크로플레이트법에서 발생할 가능성이 조금 더 높을 수 있다는 보고도 있습니다.
고도의 자동화를 위해서는 다양한 고가 장비가 요구된다는 점도 단점 중 하나입니다. 완전 자동화 시스템을 구축하기 위해서는 정밀한 자동 분주 로봇, 자동 플레이트 배양기, 고성능 자동 세척기, 마이크로플레이트 전용 원심분리기, 그리고 자동 판독기 등 다양한 종류의 고가 장비들이 필요하며, 이러한 장비들의 초기 투자 비용 및 유지 보수 비용이 상당할 수 있습니다.
일부 연구에서는 특정 약한 항체의 검출 능력, 즉 민감도에 대한 문제가 제기되기도 했습니다. 특히 액상 마이크로플레이트법의 경우, 일부 매우 약한 항체의 검출에 있어서 그 민감도가 컬럼 응집법이나 특수한 조건을 적용한 시험관법에 비해 다소 낮을 수 있다는 보고가 있습니다. (단, 고체상법인 SPRCA는 일반적으로 높은 민감도를 가지는 것으로 알려져 있습니다.)
마지막으로, 고체상법(SPRCA)은 액상법과는 다른 종류의 특이적인 간섭 요인에 영향을 받을 수 있습니다. 예를 들어, 환자의 혈청 내에 비정상적으로 높은 농도의 단백질(예: 다발성 골수종 환자의 파라프로테인)이나 피브리노겐과 같은 응고 관련 단백질, 또는 류마티스 인자(rheumatoid factor) 등이 존재할 경우, 이들이 웰 바닥에 비특이적으로 부착되어 지시 적혈구의 결합을 유발함으로써 위양성 결과를 초래할 수 있습니다. 따라서 SPRCA 결과 해석 시에는 이러한 잠재적 간섭 요인에 대한 이해와 주의가 필요합니다.
2025.04.08 - [수혈의학] - A, B형 혈액형 아형 집중 분석- 표현형, 검사법, 임상적 의의
A, B형 혈액형 아형 집중 분석- 표현형, 검사법, 임상적 의의
우리는 ABO 혈액형 시스템이 단순히 A, B, AB, O라는 네 가지 범주로만 나뉘는 것이 아니라, 그 안에 더 복잡하고 미묘한 차이들이 숨어 있다는 사실을 앞서 이야기했습니다. 특히 A형과 B형 혈액형
labdoctor.tistory.com
검사실 환경과 목적에 따른 최적의 선택
결론적으로, 컬럼 응집 기술(CAT)과 마이크로플레이트법(액상법 및 고체상법 포함)은 모두 현대 혈액은행 검사실에서 전통적인 시험관 수기법의 여러 한계점들을 극복하고 검사의 효율성, 표준화 수준, 그리고 결과의 객관성을 크게 향상시킨 매우 중요하고 가치 있는 검사 플랫폼이라고 할 수 있습니다. 하지만 이 두 가지 주요 방법론은 각각 서로 다른 독창적인 작동 원리에 기반하고 있으며, 그에 따라 뚜렷하게 구별되는 장점과 단점을 동시에 가지고 있습니다.
컬럼 응집법은 일반적으로 높은 민감도와 명확하게 구분되는 판독 결과, 그리고 간접 항글로불린 검사(IAT) 과정에서의 독보적인 편리성(세척 단계 불필요)을 가장 큰 장점으로 내세울 수 있습니다. 그러나 상대적으로 높은 소모품 비용과 검사를 위한 전용 장비가 반드시 필요하다는 점은 단점으로 작용할 수 있습니다.
마이크로플레이트법, 특히 완전 자동화 시스템과 결합될 경우, 타의 추종을 불허하는 압도적인 검사 처리 능력(high throughput)과 대량 검사 수행 시의 비용 효율성, 그리고 뛰어난 전산 데이터 관리 능력을 자랑합니다. 하지만 액상법의 경우에는 결과 판독에 있어 여전히 약간의 주관성이 개입될 여지가 있으며, IAT 수행 시 필수적인 세척 과정의 철저한 관리가 결과의 신뢰성에 매우 중요하다는 기술적인 고려사항이 있습니다. 또한 고체상법(SPRCA)은 일반적으로 높은 민감도를 제공하지만 액상법과는 다른 종류의 잠재적인 간섭 요인에 대한 깊은 이해가 필요합니다.
따라서 이 두 가지 방법 중 어떤 것이 절대적으로 더 우수하다고 단정적으로 말하기는 어렵습니다. 최적의 검사 방법을 선택하는 문제는 각 혈액은행 검사실이 처한 구체적인 운영 환경과 상황, 즉 하루에 처리해야 하는 검체량의 규모는 어느 정도인지, 가용 예산은 얼마인지, 현재 보유하고 있는 장비의 종류와 자동화 수준은 어떠한지, 검사실을 운영하는 인력의 숙련도와 경험은 어떠한지, 그리고 주로 수행하는 검사 메뉴의 종류는 무엇인지 등을 종합적으로 고려하여 신중하게 결정되어야 합니다.
가장 중요한 것은 어떤 검사 방법을 선택하여 사용하든, 항상 엄격한 내부 및 외부 품질 관리(Quality Control) 절차를 철저히 준수하고, 상세하게 기술된 표준화된 검사 절차(Standard Operating Procedure, SOP)를 정확하게 따르며, 검사 결과를 최종적으로 판독하고 해석하는 검사실 전문가의 지속적인 교육과 숙련도 유지를 위해 노력하는 것입니다. 이러한 기본적인 원칙들을 충실히 지킬 때, 우리는 비로소 컬럼 응집법이든 마이크로플레이트법이든 그 장점을 최대한 활용하여, 수혈이 필요한 모든 환자에게 가장 안전하고 가장 신뢰할 수 있는 혈액 제제를 공급한다는 혈액은행의 핵심적인 사명과 목표를 성공적으로 달성할 수 있을 것입니다.
2025.04.13 - [분자진단] - FISH (Flourescence in situ hybridization) 의 원리와 방법, 적용 분야
FISH (Flourescence in situ hybridization) 의 원리와 방법, 적용 분야
우리 몸의 세포 하나하나에는 생명의 모든 정보가 담긴 거대한 도서관, 즉 유전체가 존재합니다. 이 도서관에는 수많은 책(염색체)이 있고, 각 책에는 무수히 많은 이야기(유전자)가 적혀 있습니
labdoctor.tistory.com
2025.04.13 - [분자진단] - NGS (Next Generation Sequencing)의 개념, 원리, 방법, 적용 분야
NGS (Next Generation Sequencing)의 개념, 원리, 방법, 적용 분야
이번 시간에는 현대 생명과학과 의학 연구의 패러다임을 바꾼 혁신적인 기술, 차세대 염기서열 분석(Next Generation Sequencing, NGS)에 대해 심도 있게 알아보겠습니다. 혹시 몇 년 전, 유명 할리우드
labdoctor.tistory.com
'수혈의학' 카테고리의 다른 글
| 매번 봐도 헷갈리는 A 항원, A1 항원, A2 항원, anti-A 항체, anti-A1 항체, H 항원, anti-H 항체 완벽 정리 (0) | 2025.04.09 |
|---|---|
| 산모 - 태아의 ABO 부적합 현상의 원리와 검사, 대응법 (1) | 2025.04.08 |
| 혼합시야반응이란 (Mixed filed agglutination) 정의, 원인, 검사법 (0) | 2025.04.08 |
| A, B형 혈액형 아형 집중 분석- 표현형, 검사법, 임상적 의의 (0) | 2025.04.08 |
| 혈액 은행에서 흡착, 용출, 해리 검사의 의미와 목적, 방법 (0) | 2025.04.08 |




댓글