혈액은행 검사실에서의 업무는 단순히 환자의 ABO 혈액형과 RhD 타입을 결정하고, 이에 맞는 혈액 제제를 찾아 공급하는 일련의 과정보다 훨씬 더 복잡하고 다층적인 경우가 많습니다. 수혈의 안전성을 확보하기 위해서는 때로는 환자의 혈액 속에 숨겨진 미스터리를 풀어내야 하는, 마치 고도의 전문성이 요구되는 과학 수사와도 같은 정교한 접근이 필요합니다.
예를 들어, 환자의 혈청 안에 예상치 못했던 여러 종류의 적혈구 항체가 뒤섞여 있어 각각의 정체를 밝히기 어렵거나, 자신의 적혈구를 스스로 공격하는 자가항체(autoantibody)가 존재하여 혈청 내 모든 검사용 적혈구와 반응함으로써 그 아래 가려진, 임상적으로 더 위험할 수 있는 동종항체(alloantibody)의 존재를 파악하기 힘들게 만드는 상황들이 발생할 수 있습니다. 또한, 과거의 수혈이나 임신 경험 후에 환자의 적혈구 표면에 정체를 알 수 없는 항체가 직접 결합되어 있는 경우(직접 항글로불린 검사 양성 소견)도 흔히 마주치는 난제 중 하나입니다.
와, 정말 생각보다 훨씬 복잡한 상황들이 많군요. 혈액형만 맞추면 되는 줄 알았는데, 이런 어려운 문제들은 도대체 어떻게 해결하는 건가요? 혹시 혈액은행에만 있는 특별한 비밀 무기 같은 것이라도 있나요?
**네, 바로 이러한 복잡하고 까다로운 면역혈액학적 문제들을 해결하기 위해 혈액은행 전문가들이 사용하는 매우 중요하고 정교한 기법들이 존재합니다. 그 핵심적인 기법들이 바로 '흡착(Adsorption)', '용출(Elution)', 그리고 이 두 기법의 근본 원리가 되는 '해리(Dissociation)'의 개념인데요,
이 기술들은 단순한 혈액형 판정을 넘어서, 적혈구 항원과 항체 간의 복잡 미묘한 상호작용을 깊이 있게 파헤치고, 혈청이나 적혈구 세포 표면에 숨겨진 귀중한 정보들을 효과적으로 캐내는 데 필수적인 역할을 수행합니다. 비유하자면, 흡착은 마치 탐정이 복잡한 사건 현장에서 수많은 증거물 중에서 특정 용의자와 관련된 단서만을 골라내는 과정과 같고, 용출은 그 용의자(적혈구)에게서 결정적인 증거물(결합된 항체)을 회수하여 분석하는 과정과 유사하다고 할 수 있습니다.
이번 시간에는 혈액은행에서 난제를 해결하는 데 사용되는 이 세 가지 핵심 기법, 즉 흡착, 용출, 그리고 해리의 정확한 개념과 그 기법들이 가지는 중요한 임상적 의미, 각각의 검사가 특별히 왜 필요하며 어떤 목적을 가지고 수행되는지, 그리고 구체적으로 검사실에서는 어떤 원리와 방법들을 이용하여 이러한 검사들을 수행하는지에 대해 이전에 다루었던 내용보다 훨씬 더 깊이 있고, 상세하며, 체계적으로 파헤쳐 보도록 하겠습니다.
흡착 (Adsorption): 목표 항체를 선택적으로 낚아채는 기술
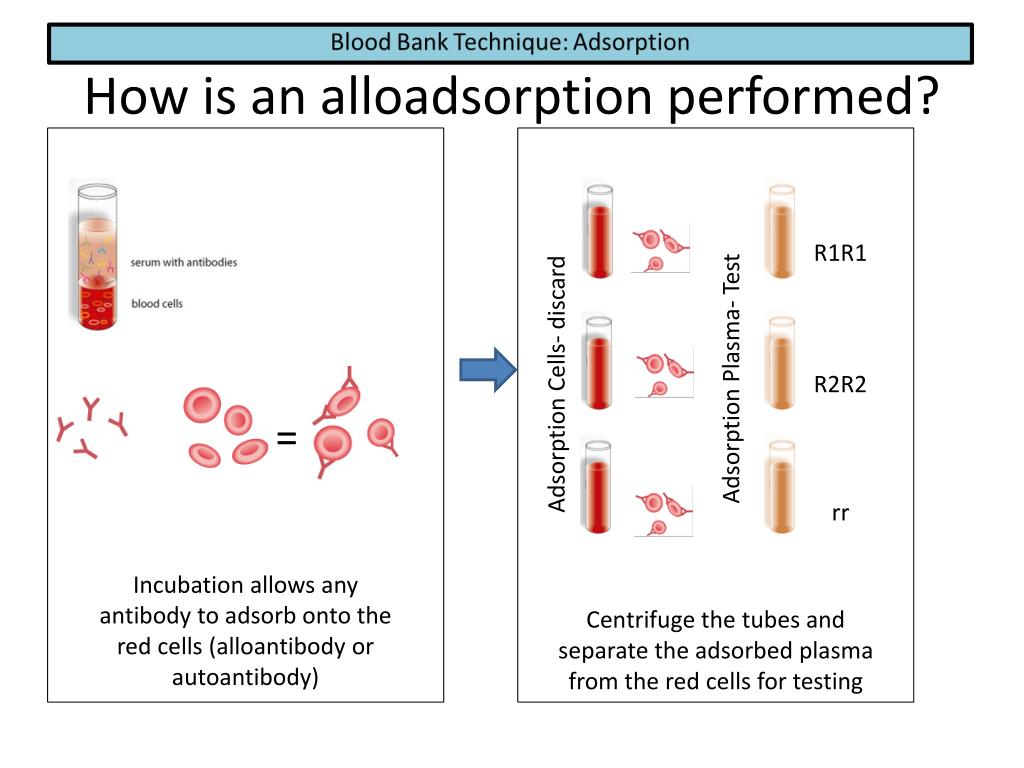
흡착(Adsorption)은 혈액은행 검사실에서 환자의 혈청(serum)이나 혈장(plasma)과 같은 액체 검체 내에 존재하는 특정 항체(antibody)를, 그 항체와 특이적으로 반응하는 항원(antigen)을 가지고 있는 적혈구 세포를 이용하여 의도적으로 결합시켜 용액 중에서 제거하는 면역학적 기법을 의미합니다.
이 과정을 좀 더 쉽게 이해하기 위해 비유를 들어보겠습니다. 마치 물과 기름이 섞인 혼합물에서 특수한 필터(항원을 가진 적혈구)를 사용하여 기름 성분(특정 항체)만을 선택적으로 걸러내는 과정과 유사하다고 생각할 수 있습니다.
또는, 수많은 종류의 열쇠가 담긴 상자(환자 혈청)에서 특정 모양의 자물쇠(항원을 가진 적혈구)를 사용하여 그 자물쇠에 맞는 열쇠(특정 항체)만을 찾아 결합시켜 분리해내는 모습을 상상해 볼 수도 있습니다. 즉, 흡착은 '선택적 제거'를 통해 복잡한 혼합물 속에서 원하는 정보를 얻거나 방해 요소를 제거하는 핵심적인 과정입니다.
그렇다면, 혈액은행 검사실에서는 왜 이러한 다소 복잡해 보이는 흡착 과정을 수행해야만 하는 것일까요? 그 목적은 매우 다양하며, 각각의 목적은 환자의 정확한 진단과 안전한 수혈을 위해 매우 중요하기 때문입니다
흡착 검사의 주요 목적
자가항체와 동종항체의 분리
흡착 검사가 수행되는 가장 중요하고 흔한 목적 중 하나는 환자의 혈청 내에 자가항체(autoantibody)와 동종항체(alloantibody)가 함께 존재할 때, 이 둘을 효과적으로 분리하는 것입니다. 특히 문제가 되는 것은 자신의 적혈구와 반응하는 자가항체입니다. 자가항체, 그중에서도 특히 온난 자가항체(warm autoantibody)는 체온(37℃)에서 환자 자신의 적혈구뿐만 아니라 검사에 사용되는 거의 모든 종류의 표준 적혈구 세포들과 광범위하게 반응하는 경향(pan-reactivity 또는 pan-agglutination)을 보입니다.
이러한 자가항체의 비특이적인 반응성은 마치 짙은 안개와 같이 작용하여, 그 속에 숨어 있을 수 있는, 수혈 시 심각한 용혈 반응을 유발할 가능성이 있는 임상적으로 매우 중요한 동종항체의 존재를 완전히 가려버리는 이른바 '마스킹 효과(masking effect)'를 나타냅니다. 따라서, 환자에게 안전한 수혈을 제공하기 위해서는 이러한 방해꾼인 자가항체를 먼저 효과적으로 제거하여 그 뒤에 숨겨진 동종항체의 유무를 명확히 확인하는 과정이 필수적입니다. 흡착 기법은 바로 이러한 상황에서 빛을 발합니다.
환자의 혈청을 자가항체와 반응할 수 있는 특정 적혈구(가장 이상적으로는 환자 자신의 적혈구)와 함께 배양함으로써 자가항체만을 선택적으로 '빨아들여(흡착시켜)' 혈청 중에서 제거하는 것입니다. 이렇게 자가항체가 제거된 깨끗한 혈청(흡착 후 혈청, adsorbed serum)을 이용하면, 마스크 뒤에 숨어 있던 위험한 동종항체가 존재하는지 여부를 비로소 명확하게 검사할 수 있게 됩니다. 이는 마치 짙은 안개를 인공적으로 걷어내고 그 뒤에 감춰져 있던 중요한 지형지물을 확인하는 과정과 같다고 할 수 있습니다.
여러 동종항체가 혼재된 경우의 분리 동정
환자의 혈청 내에 단 한 종류가 아닌, 서로 다른 여러 종류의 동종항체들이 복합적으로 섞여 있는 경우도 혈액은행에서는 종종 마주치는 어려운 상황입니다. 예를 들어, 과거에 여러 차례 수혈을 받았거나 다태 임신 경력이 있는 환자의 혈청에는 Anti-E 항체와 Anti-K 항체, 그리고 Anti-Fya 항체가 동시에 존재할 수도 있습니다. 이러한 경우, 항체 동정용 패널 검사를 시행하면 매우 복잡하고 해석하기 어려운 반응 양상이 나타나게 되어 각각의 항체 특이성을 명확하게 규명하기가 극도로 어려워집니다.
이때 흡착 기법은 복잡한 퍼즐을 푸는 데 유용한 도구가 될 수 있습니다. 만약 우리가 혈청 내에 존재할 것으로 의심되는 항체 중 하나(예: Anti-E)에 해당하는 항원(E 항원)은 가지고 있지만, 동시에 의심되는 다른 항체들의 항원(K 항원, Fya 항원)은 가지고 있지 않은 특정 항원 표현형의 적혈구를 신중하게 선택하여 사용한다면, 이 적혈구는 혈청 속의 Anti-E만을 선택적으로 흡착하여 제거할 수 있습니다.
이렇게 Anti-E가 제거된 남은 혈청을 이용하여 다시 항체 동정 검사를 수행하면, 이제는 나머지 항체들(Anti-K, Anti-Fya)의 반응 패턴만을 좀 더 명확하게 관찰할 수 있게 되어 항체 동정 과정을 훨씬 더 수월하게 진행할 수 있습니다. 이는 마치 여러 악기가 동시에 시끄럽게 연주되는 복잡한 교향곡 속에서 특정 악기(예: 시끄러운 트럼펫)의 소리만을 마법처럼 제거하여 나머지 아름다운 악기들(바이올린, 첼로)의 선율을 더 선명하게 감상하는 것과 유사한 원리라고 할 수 있습니다.
약한 항원의 존재 확인 (Confirmation)
매우 드물지만, 특정 적혈구가 어떤 항원을 매우 약한 형태로 발현하고 있는지 확인하는 데에도 흡착 기법이 간접적으로 활용될 수 있습니다. 예를 들어, 어떤 환자의 적혈구가 임상적으로 중요한 Kell(K) 항원을 매우 약하게 가지고 있는 것으로 의심되는 상황을 가정해 봅시다. 이때, 이미 그 특이성이 명확하게 알려진 강력한 Anti-K 항체를 이 의심스러운 환자 적혈구와 반응시켜 봅니다.
만약 이 적혈구에 약하게라도 K 항원이 존재한다면, Anti-K 항체가 이 적혈구 표면에 결합(흡착)될 것입니다. 물론, 단순히 항체가 소모되는 것을 측정하는 것은 어렵기 때문에, 실제로 흡착이 일어났는지 확인하기 위해서는 이후에 다시 그 항체를 적혈구로부터 분리해내는 '용출' 과정을 거쳐 용출액의 특이성을 확인하는 단계를 거쳐야 합니다. 즉, 흡착과 용출을 연계하여 약한 항원의 존재를 간접적으로 증명하는 것입니다.
특수 상황에서의 항체 제거
장기간 냉동 상태로 보존되었던 매우 희귀한 혈액 단위(rare donor units)를 해동하여 환자에게 수혈해야 하는 경우에도 흡착 과정이 고려될 수 있습니다. 냉동 및 해동 과정 중에 적혈구 세포막이 손상되거나 보존액 성분과의 상호작용 등으로 인해 예상치 못한 항체가 생성되거나 비특이적인 반응을 유발하는 물질이 생겨날 수 있는데, 이러한 불필요한 항체나 간섭 물질을 수혈 전에 흡착 과정을 통해 제거함으로써 수혈의 안전성을 높이기 위한 목적으로 사용될 수 있습니다.
그렇다면 이러한 다양한 목적을 가진 흡착 검사는 검사실에서 구체적으로 어떻게 수행될까요? 흡착을 수행하는 방법은 흡착의 구체적인 목적, 환자의 임상 상태(특히 최근 수혈 여부), 그리고 제거하고자 하는 항체의 종류(자가항체 또는 동종항체, 온난 또는 한랭 반응성)에 따라 여러 가지 전략이 사용됩니다.
흡착 방법의 종류 및 절차
자가흡착 (Auto-adsorption)
가장 이상적이고 이론적으로 가장 정확한 방법은 바로 환자 본인의 적혈구를 사용하여 환자 자신의 혈청 속에 존재하는 자가항체를 제거하는 것입니다. 이 방법의 가장 큰 장점은, 환자 혈청 내에 존재할 수 있는 동종항체는 환자 자신의 적혈구 표면에는 해당 항원이 없으므로 결합하지 않고 혈청 내에 그대로 남아있게 되는 반면, 자가항체는 환자 자신의 적혈구와 반응하여 선택적으로 제거될 수 있다는 점입니다. 따라서 자가흡착은 동종항체를 놓칠 위험 없이 자가항체만을 특이적으로 제거할 수 있는 가장 좋은 방법으로 여겨집니다.
자가흡착 절차는 다음과 같은 단계로 진행됩니다. 먼저 환자로부터 충분한 양의 혈액 검체를 채취하여 적혈구와 혈청(또는 혈장)을 분리합니다. 채취된 환자 적혈구는 생리식염수를 이용하여 여러 번(보통 3-4회) 깨끗하게 세척하여 부착된 혈장 단백질 등을 제거합니다. 이때 반드시 확인해야 할 중요한 정보는 환자의 직접 항글로불린 검사(DAT) 결과입니다. 만약 DAT 결과가 강하게 양성(예: 3+ 또는 4+)이라면, 이는 환자의 적혈구 표면이 이미 생체 내에서 자가항체로 거의 포화 상태에 가깝게 코팅되어 있다는 것을 의미합니다.
이러한 상태의 적혈구는 추가적인 자가항체가 결합할 수 있는 항원 부위가 거의 남아있지 않기 때문에, 그대로 흡착에 사용하면 효율이 매우 떨어지게 됩니다. 따라서 이런 경우에는 흡착 과정을 시작하기 전에 적절한 전처리 과정을 통해 적혈구 표면에 이미 부착된 자가항체를 일부 제거하거나 항체가 더 잘 결합할 수 있는 조건을 만들어주는 것이 필요합니다.
이를 위해 흔히 사용되는 방법은 ZZAP 시약(항체의 이황화 결합을 끊는 환원제인 Dithiothreitol(DTT)과 단백질 분해 효소인 Papain의 혼합물)을처리하거나, 또는 피신(ficin)이나 파파인(papain)과 같은 단백질 분해 효소를 단독으로 처리하는 것입니다. 이러한 처리는 적혈구 표면의 IgG 항체를 일부 제거하거나 변성시키고, 일부 항원(예: Rh 항원)의 반응성을 증강시켜 이후의 흡착 효율을 높이는 데 도움을 줄 수 있습니다. (단, 효소 처리는 Duffy, MNSs 항원 등 일부 항원을 파괴할 수 있으므로 주의가 필요합니다.)
이렇게 전처리된 (또는 DAT가 음성이거나 약양성이어서 전처리가 필요 없는) 환자 적혈구를 준비된 환자 혈청과 일정한 부피 비율(예: 농축 적혈구 1 부피 대 혈청 1 부피 또는 2 부피)로 신중하게 혼합합니다. 이 혼합액을 제거하고자 하는 자가항체의 최적 반응 온도에서 일정 시간 동안 충분히 배양(incubation)합니다.
예를 들어, 온난 자가항체(warm autoantibody)를 제거하기 위해서는 37℃ 항온 수조에서 최소 30분에서 1시간 정도 배양하고, 한랭 자가항체(cold autoantibody)를 제거하기 위해서는 4℃의 냉장 온도에서 1시간 이상 충분히 배양하는 것이 일반적입니다. 배양이 완료되면, 혼합액을 원심분리하여 항체가 결합된 적혈구는 시험관 바닥에 단단히 침전시키고, 상층액인 혈청(이것이 1차 흡착 후 혈청입니다)만을 조심스럽게 다른 깨끗한 시험관으로 옮겨 수집합니다.
환자의 혈청 내 자가항체의 농도(역가, titer)가 매우 높거나 항체의 결합력(affinity)이 강한 경우에는, 단 한 번의 흡착 과정만으로는 혈청 내 자가항체를 완전히 제거하기 어려울 수 있습니다. 이러한 경우에는 새롭게 준비된 자가 적혈구를 이용하여 이 흡착 과정을 여러 번(보통 2회 또는 3회, 때로는 그 이상) 반복해야 합니다. 매 흡착 단계를 마칠 때마다, 분리된 혈청의 일부를 이용하여 자가항체가 충분히 제거되었는지 확인하는 검사(예: 흡착 후 혈청과 환자 자신의 적혈구 또는 표준 O형 적혈구를 반응시키는 자가대조(autocontrol) 시험 또는 항체 선별 검사)를 수행하여, 반응이 음성이 될 때까지 추가 흡착을 진행할지 여부를 신중하게 판단합니다.
최종적으로 자가항체가 만족스럽게 제거되었다고 판단된 흡착 후 혈청(final adsorbed serum)을 사용하여, 동종항체의 존재 유무를 확인하기 위한 항체 선별 검사(antibody screening test) 및 필요한 경우 항체 동정 검사(antibody identification test)를 진행하게 됩니다.
자가흡착은 이론적으로 가장 우수한 방법임에도 불구하고, 적용할 수 없는 치명적인 제한점을 가지고 있습니다. 가장 중요한 것은 환자가 만약 최근 3개월 이내에 다른 사람의 혈액을 수혈받은 병력이 있다면, 환자의 혈액 순환 내에는 수혈을 통해 들어온 공여자 유래의 적혈구(allogeneic red cells)가 상당수 섞여 있을 가능성이 매우 높다는 점입니다.
이러한 상태에서 자가흡착을 시행하게 되면, 환자 혈청 내의 자가항체뿐만 아니라, 만약 환자가 가지고 있는 동종항체가 있다면 이 동종항체까지도 공여자 적혈구 표면에 존재하는 해당 항원(환자 자신에게는 없는 항원)에 결합하여 함께 흡착, 제거될 수 있습니다. 이는 마치 중요한 증거를 찾으려다 오히려 그 증거를 파괴해 버리는 것과 같아서, 결과적으로 임상적으로 매우 중요한 동종항체를 놓치게 되는 심각한 오류를 초래할 수 있습니다. 따라서, 최근 3개월 이내 수혈력이 있는 환자에게는 자가흡착을 절대로 시행해서는 안 된다는 것이 혈액은행의 중요한 원칙입니다. 또한, 환자가 극심한 빈혈 상태이거나 다른 이유로 흡착 과정에 필요한 충분한 양의 자기 적혈구를 확보하기 어려운 경우에도 자가흡착은 현실적으로 적용하기 어렵습니다.
동종흡착 (Allo-adsorption 또는 Allogeneic adsorption)
환자 자신의 적혈구를 사용할 수 없는 불가피한 상황(예: 최근 수혈력, 적혈구 부족 등)에서 자가항체를 제거해야 할 필요가 있을 때 선택하는 차선책이 바로 동종흡착입니다. 이 방법은 환자가 아닌, 건강한 혈액 공여자로부터 얻은, 특정 항원 표현형을 이미 정확하게 알고 있는 적혈구 세포들을 '대신' 사용하여 흡착을 수행하는 것입니다.
동종흡착을 성공적으로 수행하기 위한 가장 큰 어려움이자 핵심 과제는, 제거하고자 하는 자가항체는 효과적으로 흡착하여 제거하면서도, 동시에 환자가 가지고 있을 가능성이 있는 임상적으로 중요한 동종항체들은 흡착 과정에서 함께 제거되지 않고 혈청 내에 그대로 남겨둘 수 있도록, 매우 신중하고 전략적으로 흡착용 공여자 적혈구의 항원 표현형 조합을 선택해야 한다는 점입니다. 이는 마치 복잡한 화학 반응 속에서 특정 촉매(자가항체)는 비활성화시키면서도, 중요한 반응 중간체(동종항체)는 손상시키지 않고 보존해야 하는 정밀한 화학 공정과도 비견될 수 있습니다.
동종흡착을 수행하기 위한 절차와 전략, 특히 '차이 흡착(Differential Adsorption)'이라고 불리는 접근법은 다음과 같습니다. 먼저 환자의 ABO/RhD 혈액형 정보와 과거 수혈력, 임신력 등을 바탕으로 환자가 가지고 있을 가능성이 높은 동종항체의 종류를 예측하는 것이 중요합니다. 예를 들어, 환자가 O형이고 RhD 음성이며 과거 수혈력이 있는 여성이라면, Rh 시스템 항체(Anti-D, C, E, c, e)나 Kell 시스템 항체(Anti-K), Kidd 시스템 항체(Anti-Jka, Jkb), Duffy 시스템 항체(Anti-Fya, Fyb) 등을 가질 가능성을 우선적으로 고려해야 합니다.
다음 단계는, 이렇게 의심되는 주요 동종항체들에 해당하는 항원은 가지고 있지 않으면서(negative for the antigen corresponding to the suspected alloantibody), 동시에 제거하고자 하는 자가항체(온난 자가항체는 대부분의 적혈구와 반응하므로 크게 문제되지 않음)와는 반응할 수 있는 특정 항원 조합을 가진 공여자 적혈구들을 신중하게 선택하는 것입니다.
동종흡착에서 가장 널리 사용되는 표준적인 전략 중 하나는 Rh 시스템 항체의 가능성을 염두에 두면서 온난 자가항체를 제거하고자 할 때 사용하는 '차이 흡착(Differential Adsorption)' 방법입니다. 이를 위해서는 표현형이 서로 다른 최소한 세 가지 종류의 공여자 적혈구를 준비하는 것이 일반적입니다. 가장 흔하게 사용되는 조합은 R1R1 (표현형: D+C+E-c-e+), R2R2 (표현형: D+C-E+c+e-), 그리고 rr (표현형: D-C-E-c+e+) 이렇게 세 가지입니다. 환자의 혈청 검체를 세 부분으로 정확히 나누어, 각각의 혈청 부분을 이 세 종류의 세포 각각과 따로 흡착시키는 과정을 진행합니다.
- R1R1 (DCe/DCe) 세포로 흡착시킨 혈청 분석: R1R1 세포는 E 항원과 c 항원이 없습니다. 따라서 만약 환자의 원래 혈청에 Anti-E나 Anti-c 동종항체가 존재했다면, 이 항체들은 R1R1 세포에 흡착되지 않고 이 흡착 후 혈청에 그대로 남아있게 됩니다. 반면, Anti-D, Anti-C, Anti-e 등 다른 항체가 있었다면 이들은 R1R1 세포에 흡착되어 제거될 수 있습니다. 자가항체 역시 이 세포와 반응하여 흡착됩니다.
- R2R2 (DcE/DcE) 세포로 흡착시킨 혈청 분석: R2R2 세포는 C 항원과 e 항원이 없습니다. 따라서 만약 환자 혈청에 Anti-C나 Anti-e 동종항체가 존재했다면, 이 항체들은 흡착되지 않고 이 흡착 후 혈청에 남아있게 됩니다. 반면, Anti-D, Anti-E, Anti-c 등은 흡착될 수 있습니다.
- rr (dce/dce) 세포로 흡착시킨 혈청 분석: rr 세포는 D, C, E 항원이 모두 없습니다. 따라서 만약 환자 혈청에 Anti-D, Anti-C, 또는 Anti-E 동종항체가 존재했다면, 이 항체들은 rr 세포에 흡착되지 않고 이 흡착 후 혈청에 남아있게 됩니다. 반면, Anti-c나 Anti-e는 흡착될 수 있습니다.
이렇게 세 가지 서로 다른 표현형의 세포로 각각 흡착시킨 후 얻어진 세 종류의 흡착 후 혈청을 각각 항체 동정용 패널 세포(antibody identification panel cells)들과 반응시켜 그 결과를 면밀히 비교 분석합니다. 예를 들어, R1R1 흡착 후 혈청에서는 Anti-E 반응 패턴이 명확하게 나타나고, R2R2 및 rr 흡착 후 혈청에서는 Anti-E 반응이 사라졌다면, 이는 환자가 Anti-E 동종항체를 가지고 있음을 강력하게 시사하는 결과입니다.
이러한 방식으로, 어떤 항체가 어떤 특정 표현형의 세포에 의해 '선택적으로' 흡착되어 제거되었고, 어떤 항체가 흡착되지 않고 특정 흡착 후 혈청에 남아있는지를 논리적으로 비교 분석함으로써, 자가항체의 광범위한 반응성이라는 방해 요인을 효과적으로 제거하고 그 뒤에 숨겨져 있던 동종항체의 정확한 특이성을 추론해낼 수 있습니다. 동종흡착 역시 자가항체의 역가가 매우 높다면 여러 번의 반복 흡착이 필요할 수 있으며, 환자가 Kell 항체(Anti-K)를 가질 가능성이 높다고 판단되면 사용하는 세 종류의 흡착용 세포 모두 Kell 항원 음성인 것을 사용하는 등 환자의 상황에 맞춰 추가적인 고려가 필요할 수 있습니다.
온도 기반 흡착 전략
흡착 반응의 효율성은 항원-항체 반응이 가장 잘 일어나는 최적 온도 조건에서 수행될 때 극대화될 수 있습니다. 따라서 제거하고자 하는 항체의 온도 반응 특성에 맞춰 흡착 온도를 조절하는 것이 중요합니다. 온난 자가항체(Warm autoantibody)는 그 이름에서 알 수 있듯이 인체 내부의 체온(37℃) 환경에서 가장 강하게 반응하는 특성을 가지므로, 온난 자가항체를 제거하기 위한 흡착은 일반적으로 37℃ 항온 수조에서 수행하는 것이 표준적인 방법입니다. 반대로, 한랭 자가항체(Cold autoantibody)는 저온(주로 4℃의 냉장 온도 또는 20-24℃의 실온)에서 가장 강한 반응성을 나타내므로, 이러한 한랭 자가항체를 제거하기 위해서는 4℃ 또는 실온에서 흡착(이를 '냉흡착(Cold adsorption)'이라고 함)을 수행해야 합니다.
특히, 한랭 자가항체는 종종 I/i 혈액 그룹 시스템의 I 항원에 대한 특이성(Anti-I)을 갖는 경우가 매우 흔합니다. 성인의 적혈구는 대부분 I 항원을 매우 강하게 발현하는 반면, 신생아의 적혈구(제대혈 적혈구)는 i 항원을 강하게 발현하고 I 항원은 매우 약하게 발현하는 특징이 있습니다. 따라서, 성인 환자의 혈청에서 강력한 Anti-I 자가항체를 제거하기 위한 냉흡착을 수행할 때는, 환자 자신의 적혈구(만약 사용 가능하다면)를 사용하는 것이 가장 좋지만, 그것이 불가능할 경우에는 I 항원이 거의 발현되지 않는 제대혈 유래 적혈구(cord blood red cells)나, 매우 드물지만 성인 중에도 i 표현형을 가진 공여자의 적혈구를 사용하는 것이, 자가항체(Anti-I)는 효과적으로 제거하면서 혹시 존재할 수 있는 다른 동종항체에는 영향을 덜 미치는 방법이 될 수 있습니다.
과거에는 매우 강력한 한랭 자가항체(특히 Anti-I)를 제거하기 위한 방법으로 토끼 적혈구 스트로마(Rabbit Erythrocyte Stroma, RES)를 이용한 흡착이 시도되기도 했습니다. 토끼 적혈구는 사람의 I 항원과 유사한 구조를 가지고 있어 Anti-I를 효과적으로 흡착할 수 있었지만, 동시에 다른 혈액 그룹 항체들까지 비특이적으로 흡착하는 문제점과 시약 준비의 어려움 등으로 인해 현재 임상 검사실에서는 거의 사용되지 않고 있습니다.
성공적인 흡착 검사를 위해서는 단순히 정해진 절차를 기계적으로 따르는 것 이상의 세심한 주의와 엄격한 품질 관리가 요구됩니다. 사용하는 흡착용 적혈구 시약의 품질(정확한 항원 표현형 정보, 유효기간 준수, 적절한 보관 상태 등)이 결과의 신뢰성에 결정적인 영향을 미치며, 혼합하는 적혈구와 혈청의 상대적인 비율 역시 흡착 효율을 좌우하는 중요한 변수입니다.
또한, 정확한 배양 온도를 일정하게 유지하고 충분한 배양 시간을 확보하는 것이 필수적이며, 환자 혈청 내 자가항체의 강도(역가)를 고려하여 필요한 반복 흡착 횟수를 적절하게 결정하는 경험과 판단력이 중요합니다. 그리고 아무리 강조해도 지나치지 않는 것은, 모든 흡착 단계 사이사이와 최종 단계에서 적혈구를 깨끗하게 세척하여 불필요한 혈청 단백질을 완전히 제거하는 과정입니다. 이는 흡착 후 혈청의 순도를 높이고 위양성 결과를 방지하는 데 있어 기본 중의 기본이라고 할 수 있습니다.
용출 (Elution) : 적혈구에 달라붙은 항체를 떼어내 회수하는 기술
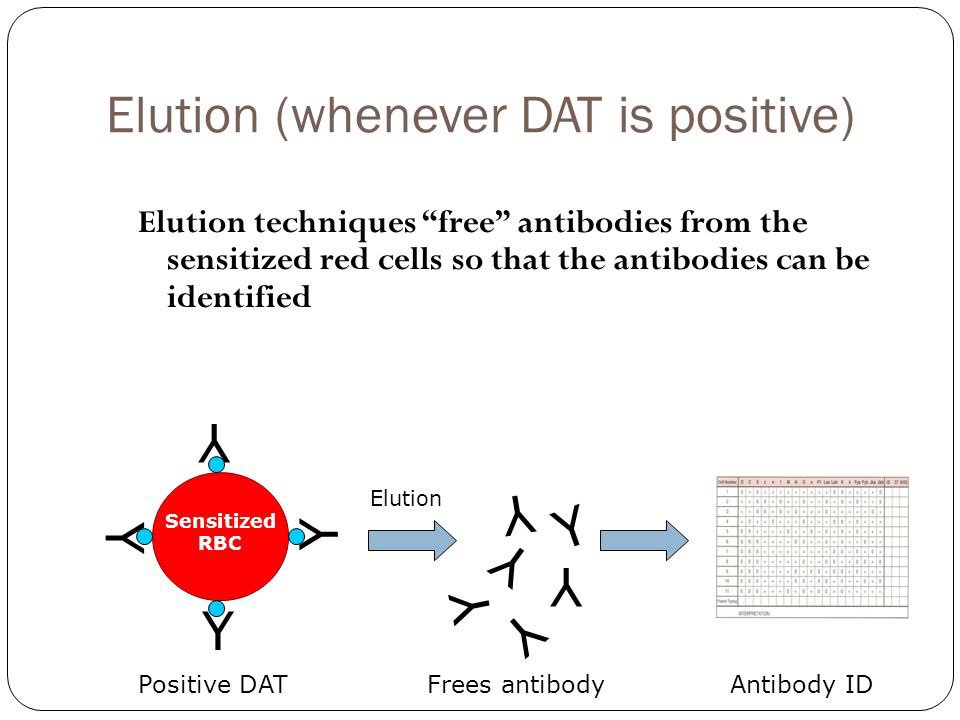
용출(Elution)은 앞서 설명한 흡착과는 정반대의 개념으로 작용하는 기법입니다. 즉, 이미 적혈구 세포의 표면에 단단히 결합되어 있는 항체를 인위적인 방법을 사용하여 그 결합을 효과적으로 끊어내고 분리(dissociation)하여 순수한 형태로 회수하는 과정을 의미합니다.
흡착을 스펀지가 물을 빨아들이는 과정에 비유했다면, 용출은 그 물을 흠뻑 머금은 스펀지를 강하게 비틀어 짜서 그 안에 담겨 있던 물(항체)만을 다시 분리해내는 과정에 해당한다고 할 수 있습니다. 또는, 강력한 자석에 달라붙어 있는 수많은 쇳가루(항체)들을 어떤 특별한 처리를 통해 자석(적혈구)으로부터 깔끔하게 떼어내어 수집하는 과정으로도 상상해 볼 수 있습니다. 이렇게 적혈구로부터 성공적으로 분리하여 회수한, 정체불명의 항체를 포함하고 있는 용액을 우리는 특별히 '용출액(eluate)'이라고 명명합니다.
혈액은행 검사실에서 용출 검사는 매우 강력하고 필수적인 진단 도구로서의 독보적인 가치를 지닙니다. 용출 검사는 특히 다음과 같은 매우 중요한 임상적 목적들을 달성하기 위해 수행됩니다.
용출 검사의 주요 목적
직접 항글로불린 검사(DAT) 양성 원인 규명
용출 검사가 수행되는 가장 중요하고 핵심적인 목적은 바로 '직접 항글로불린 검사(Direct Antiglobulin Test, DAT)' 또는 '직접 쿰스 검사(Direct Coombs Test)'라고 불리는 검사에서 양성 결과가 나온 근본적인 이유를 명확하게 규명하는 것입니다. 환자의 적혈구를 직접 검사하는 DAT가 양성이라는 결과는, 환자의 적혈구가 이미 환자의 몸 안에서(in vivo) 면역글로불린(immunoglobulin, 주로 IgG 클래스의 항체)이나 보체 단백질(complement proteins, 주로 C3d 성분)과 같은 면역 관련 단백질들로 코팅되어 있다는 사실을 의미합니다.
이는 환자의 몸속에서 어떤 형태로든 적혈구를 표적으로 하는 면역학적인 사건이 발생했거나 진행 중임을 강력하게 시사하는 매우 중요한 검사 소견입니다. 하지만 DAT 검사 자체만으로는 적혈구를 코팅하고 있는 그 물질이 정확히 무엇인지, 즉 어떤 종류의 항체가, 왜, 어떤 항원에 결합하여 적혈구 표면에 붙어있는지에 대한 구체적인 정보는 전혀 알려주지 못합니다. DAT는 단지 '무언가 붙어 있다'는 사실만을 알려줄 뿐입니다.
바로 이 지점에서, 용출 검사가 결정적인 역할을 수행하게 됩니다. 용출 검사는 이렇게 적혈구 표면에 직접 부착되어 있는 항체를 효과적으로 분리하여 순수하게 회수한 뒤, 이 회수된 항체(용출액)가 과연 어떤 특정 적혈구 항원에 대해 특이성(specificity)을 가지고 있는지를 밝혀냄으로써, DAT 양성을 유발한 근본적인 원인이 무엇인지를 명확하게 규명하는 데 핵심적인 정보를 제공합니다. 용출액 검사를 통해 우리는 마침내 '적혈구에 붙어 있는 것은 무엇인가?'라는 질문에 대한 답을 얻을 수 있는 것입니다.
용출 검사가 특히 중요한 임상 상황들의 예시는 다음과 같습니다.
- 신생아 용혈성 질환(Hemolytic Disease of the Fetus and Newborn, HDFN)의 진단: 엄마와 아기의 혈액형이 부적합한 경우(예: 엄마 O형-아기 A형/B형, 엄마 RhD 음성-아기 RhD 양성), 엄마의 혈액 속에 있는 특정 항체(IgG 클래스)가 태반을 통과하여 아기의 혈액 속으로 들어가 아기의 적혈구를 공격할 수 있습니다. 이로 인해 아기는 태어나면서부터 빈혈, 황달 등의 증상을 보이는 HDFN을 겪을 수 있습니다. 이때 태어난 아기의 제대혈(cord blood) 검체에서 DAT가 양성으로 나온다면 HDFN을 강력히 의심할 수 있습니다. 용출 검사를 통해 아기 적혈구에 결합된 항체를 분리하여 검사하면, 그 항체가 엄마로부터 넘어온 IgG 형태의 Anti-A 또는 Anti-B 항체인지, 혹은 엄마로부터 넘어온 Anti-D 항체인지를 명확하게 확인할 수 있어 HDFN의 원인을 정확히 진단하고 적절한 치료 계획을 세우는 데 결정적인 도움을 줍니다.
- 지연성 용혈성 수혈 부작용(Delayed Hemolytic Transfusion Reaction, DHTR)의 진단: 환자가 수혈을 받은 지 며칠(보통 3일에서 14일 사이) 또는 몇 주가 지난 후에 원인을 알 수 없는 빈혈의 악화, 황달, 발열, 혈색소뇨 등의 증상을 보이면서 DAT가 양성으로 전환되는 경우가 있습니다. 이는 지연성 용혈성 수혈 부작용(DHTR)을 강력히 시사하는 소견입니다. DHTR은 환자가 과거의 수혈이나 임신 등으로 인해 특정 적혈구 항원(수혈된 혈액에는 있지만 환자 자신에게는 없는 항원)에 대해 이미 감작(sensitization)되어 소량의 항체를 가지고 있다가, 이번 수혈을 통해 동일한 항원에 다시 노출되면서 면역 기억 반응(anamnestic response)이 촉발되어 해당 항체의 생산량이 급격히 증가하고, 이 항체가 수혈된 공여자 적혈구를 파괴하여 발생하는 것으로 생각됩니다. 이 경우, 환자 적혈구로부터 용출 검사를 시행하여 얻어진 용출액 내에서 수혈된 공여자 적혈구의 특정 항원(예: Kidd 시스템의 Jka 또는 Jkb 항원, Duffy 시스템의 Fya 또는 Fyb 항원, Kell 시스템의 K 항원 등)에 대한 동종항체(alloantibody)를 검출한다면 DHTR을 확진하는 데 결정적인 증거를 제공합니다.
- 자가면역 용혈성 빈혈(Autoimmune Hemolytic Anemia, AIHA)의 조사: AIHA는 환자 자신의 면역 시스템이 오류를 일으켜 자신의 적혈구 표면 항원에 대한 자가항체(autoantibody)를 생성하고, 이 자가항체가 적혈구를 파괴하여 용혈성 빈혈을 유발하는 질환입니다. AIHA 환자들은 대부분의 경우 DAT 양성 소견을 보입니다. 용출 검사는 이러한 AIHA 환자의 진단과 관리에 중요한 정보를 제공할 수 있습니다. 환자 적혈구에 결합된 자가항체를 용출하여 그 특이성을 분석함으로써, 이 자가항체가 단순히 모든 적혈구와 비특이적으로 반응하는 것인지, 아니면 특정 혈액형 시스템의 항원(예: Rh 시스템의 e 항원이나 C 항원 등)에 대해 상대적인 특이성(relative specificity)을 보이는지를 파악할 수 있습니다. 이러한 정보는 AIHA의 아형을 분류(예: 온난 AIHA, 한랭 AIHA 등)하고 예후를 예측하며 치료 전략을 결정하는 데 도움이 될 수 있습니다. 또한, AIHA 환자 중 일부는 자가항체와 함께 임상적으로 중요한 동종항체를 동시에 가지고 있는 경우도 있는데, 이러한 상황은 수혈 시 매우 위험할 수 있습니다. 용출액 검사를 통해 자가항체 외에 혹시 숨겨져 있을지 모르는 동종항체의 존재 가능성을 확인하는 데에도 용출 검사는 중요한 단서를 제공할 수 있습니다.
복합적인 항체 문제 해결 및 특이성 확인
혈청 내에 여러 종류의 항체가 복합적으로 존재하거나, 매우 강력한 자가항체 또는 비특이적인 반응이 동반되어 일반적인 항체 동정 검사만으로는 각각의 항체 특이성을 명확하게 분리하고 동정하기 어려운 경우가 있습니다. 이러한 복잡한 상황에서 용출 기법은 문제 해결을 위한 보조적인 전략으로 활용될 수 있습니다. 예를 들어, 특정 항체(예: Anti-Fya)의 존재가 강력히 의심되지만 다른 항체들의 간섭으로 확신하기 어려울 때, Fya 항원을 가지고 있는 특정 적혈구만을 선택적으로 이용하여 환자 혈청에서 의심되는 Anti-Fya를 먼저 흡착시킵니다.
그런 다음, 이 적혈구로부터 다시 항체를 용출시켜 회수하고, 얻어진 용출액이 오직 Anti-Fya의 특이성만을 보이는지를 확인함으로써 원래 의심했던 Anti-Fya 항체의 존재를 명확하게 확인하거나 다른 항체와의 분리를 시도하는 데 도움을 줄 수 있습니다.
약한 항원의 존재 확인
앞서 흡착의 목적에서 잠시 언급했듯이, 용출 기법은 특정 적혈구가 어떤 항원을 매우 약하게 발현하고 있는지 여부를 확인하는 과정에서도 중요한 역할을 할 수 있습니다. 예를 들어, 어떤 적혈구가 약한 D 항원(Weak D)을 가지고 있는지 확실하게 증명하고 싶을 때, 먼저 그 특이성이 잘 알려진 강력한 Anti-D 항체를 이 의심스러운 적혈구에 반응시켜 결합(흡착)시킵니다. 그런 다음, 철저한 세척 과정을 거친 후, 이 적혈구로부터 다시 항체를 용출하여 회수합니다.
마지막으로, 이 용출액 속에 들어있는 항체가 원래 사용했던 Anti-D 항체의 특이성과 정확히 일치하는지를 확인합니다. 만약 용출액에서 명확한 Anti-D 반응성이 확인된다면, 이는 원래의 적혈구 표면에 D 항원이 약하게나마 존재했었음을 간접적이지만 확실하게 증명하는 결과가 됩니다.
그렇다면 검사실에서는 적혈구 표면에 마치 자석처럼 단단히 달라붙어 있는 항체를 어떻게 효과적으로 떼어내어 분리해낼 수 있을까요? 용출 검사는 적혈구 표면의 항원과 결합하고 있는 항체 사이의 비교적 약한 비공유결합(non-covalent bonds)을 인위적으로 깨뜨리는 원리에 기반합니다.
이 결합을 약화시키는 방법에 따라 여러 가지 구체적인 용출 기법들이 개발되어 사용되고 있습니다. 항원과 항체는 주로 수소 결합(hydrogen bonds), 이온 결합(ionic bonds), 반 데르 발스 힘(van der Waals forces), 그리고 물 분자를 밀어내는 소수성 상호작용(hydrophobic interactions)과 같은 약한 힘들의 복합적인 조합을 통해 서로를 인식하고 결합합니다. 따라서 이러한 약한 결합들을 효과적으로 방해하거나 끊어낼 수 있는 특정 물리적 조건(예: 온도 변화)이나 화학적 조건(예: pH 변화, 특정 화학물질 처리)을 가해주면, 항체는 항원으로부터 분리되어 떨어져 나올 수 있게 됩니다(해리).
용출 방법의 종류 및 원리
온도 변화를 이용하는 방법
- 가열 용출 (Heat Elution): 가장 오래되었고 기술적으로 가장 간단한 용출 방법 중 하나입니다. 항체로 코팅된 적혈구를 생리식염수나 특수 제조된 용출용 완충액에 부유시킨 후, 일반적으로 56℃ 정도의 온도로 설정된 항온 수조에서 일정 시간(예: 10분 정도) 동안 가열합니다. 온도가 상승하면 분자의 열 운동 에너지(kinetic energy)가 크게 증가하여 항원과 항체 분자 모두의 진동이 활발해지고, 이로 인해 둘 사이를 결합시키고 있던 약한 비공유결합들이 불안정해져서 결국 항체가 항원으로부터 떨어져 나가게 되는 원리를 이용합니다. 이 방법은 기술적으로 매우 간단하고 특별한 시약이 필요 없다는 장점이 있으며, 특히 ABO 혈액형 부적합에 의한 신생아 용혈성 질환(ABO HDFN)에서 아기의 적혈구 표면에 결합된 엄마로부터 유래한 IgG 형태의 Anti-A 또는 Anti-B 항체를 용출시키는 데 빠르고 효과적으로 사용될 수 있습니다. 하지만, 56℃라는 비교적 높은 온도는 일부 열에 약한 적혈구 항원이나 회수되는 항체 단백질 자체를 변성(denaturation)시켜 항체의 활성을 영구적으로 잃게 만들 수 있다는 잠재적인 단점을 가지고 있습니다. 따라서 모든 종류의 항체 용출에 적합한 방법은 아닙니다.
- 동결-융해 용출 (Freeze-Thaw Elution, 예: Lui Easy Freeze 방법): 이 방법은 항체로 코팅된 적혈구 현탁액을 매우 빠른 속도로 동결(freezing)시켰다가(예: 드라이아이스와 에탄올 혼합물 또는 -70℃ 이하의 초저온 냉동고 사용) 다시 급격하게 융해(thawing)시키는 과정을 이용합니다. 이 과정에서 세포 내부와 외부의 물이 얼음 결정을 형성하면서 팽창하여 적혈구 세포막에 심각한 물리적인 손상을 입히게 되고, 결국 세포가 터져 내용물이 방출되는 용혈(hemolysis)이 일어납니다. 이 격렬한 세포 파괴 과정 중에 세포막 표면에 결합되어 있던 항체들도 함께 떨어져 나와 용출액 속으로 유리되는 원리를 이용합니다. 동결-융해 용출법 역시 ABO HDFN 조사 시 제대혈(cord blood) 검체에서 IgG 클래스의 Anti-A 또는 Anti-B를 용출시키는 데 매우 간편하고 신속하게(보통 몇 분 안에 완료 가능) 사용될 수 있다는 큰 장점을 가지고 있습니다. 하지만 이 방법으로 회수되는 항체의 양이나 활성은 다른 방법에 비해 상대적으로 낮을 수 있으며, 주로 ABO HDFN 조사에 특화되어 사용되는 경향이 있습니다.
pH 변화를 이용하는 방법- 산 용출 (Acid Elution, 예: Glycine Acid Elution 또는 Digitoni-Acid Elution)
현재 전 세계적으로 대부분의 혈액은행 검사실에서 표준적인 용출 방법으로 가장 널리 채택되어 사용되고 있는 기법이라고 할 수 있습니다. 이 방법은 특히 온난 환경(37℃)에서 반응하는 IgG 클래스의 항체(대부분의 임상적으로 유의한 동종항체 및 온난 자가항체를 포함)를 매우 효과적으로 용출시키는 데 탁월한 성능을 보이는 것으로 알려져 있습니다. 산 용출법의 핵심 원리는 pH를 순간적으로 매우 낮은 수준으로 떨어뜨려 항원-항체 결합을 약화시키는 것입니다.
구체적인 절차는 다음과 같습니다. 먼저 항체로 코팅된 환자의 적혈구를 매우 철저하게 세척하여 준비합니다. 그런 다음, 이 세척된 적혈구를 pH 3.0 정도의 매우 낮은 산성 용액(주로 글리신-염산 완충액, Glycine-HCl buffer가 사용됨)과매우 짧은 시간(보통 1분에서 2분 이내) 동안 접촉시킵니다. 이렇게 극단적으로 낮은 pH 환경에서는 항원과 항체를 구성하는 단백질 표면에 존재하는 아미노산 잔기들의 전하 상태(protonation state)가 급격하게 변화하고, 이로 인해 단백질의 전체적인 3차원적 구조(conformation)에도 미세한 변형이 일어나게 됩니다.
이러한 변화는 결국 항원과 항체 사이의 정전기적 인력(ionic interaction)이나 수소 결합 등 결합력의 균형을 깨뜨려 항체가 적혈구 표면으로부터 쉽게 떨어져 나오도록(해리되도록) 유도합니다. 이렇게 항체가 분리된 직후, 매우 신속하게 다량의 차가운 중성 완충액(neutralizing buffer, 예: Tris buffer 또는 Phosphate buffered saline(PBS))을 첨가하여 용액의 pH를 다시 생리적인 중성 범위(pH 7.0-7.4)로 즉시 되돌려주어야 합니다.
이는 낮은 pH 조건에서 분리된 항체 단백질이 영구적으로 변성되어 그 활성을 잃어버리는 것을 방지하고 안정화시키기 위한 매우 중요한 단계입니다. 산 용출법은 다른 방법에 비해 비교적 높은 항체 회수율(recovery rate)을 보이며, 용출 과정 중에 적혈구 항원에 가해지는 손상이 상대적으로 적고, 사용하는 시약이 비교적 안전하며, 재현성이 높다는 장점 때문에 오늘날 대부분의 임상 혈액은행에서 표준 용출법(standard elution method)으로 가장 선호되고 있습니다.
유기 용매를 이용하는 방법 (과거에는 사용되었으나 현재는 거의 사용되지 않음)
과거 혈액은행의 초기 역사에서는 에테르(ether), 디클로로메탄(dichloromethane, DCM), 자일렌(xylene)과 같은 다양한 종류의 유기 용매(organic solvents)를 이용한 용출 방법도 널리 사용되었습니다. 이러한 유기 용매들은 적혈구 세포막의 주요 구성 성분인 지질(lipid)을 효과적으로 용해시키거나 그 구조를 변형시킬 수 있습니다.
또한, 항원-항체 결합에 중요한 역할을 하는 것으로 알려진 소수성 상호작용(hydrophobic interactions)을 효과적으로 방해함으로써 항체를 항원으로부터 해리시키는 원리를 이용합니다. 이 방법들은 종종 매우 우수한 항체 회수율을 보여주었지만, 결정적인 단점을 가지고 있었습니다.
바로 사용되는 유기 용매들이 대부분 인체에 유해한 독성을 가지고 있을 뿐만 아니라, 대부분 가연성이 매우 높고 일부는 폭발의 위험성까지 내포하고 있어 검사실 환경에서의 작업자 안전성 문제가 매우 심각하게 대두되었습니다. 따라서, 보다 안전하면서도 효과적인 다른 용출 방법들(특히 산 용출법)이 개발되고 보급됨에 따라, 현재는 이러한 유기 용매를 기반으로 하는 용출법은 임상 검사실에서는 거의 사용되지 않고 있으며, 특별한 연구 목적 외에는 사실상 폐기된 방법으로 간주되고 있습니다.
용출 과정을 성공적으로 수행하고 그 결과의 신뢰성을 확보하기 위해 절대적으로 강조되어야 하는 매우 중요한 단계 중 하나는, 용출 과정을 시작하기 전에 항체로 코팅된 환자의 적혈구를 극도로 철저하게 세척하는 과정입니다. 만약 이 세척 과정이 불충분하여 적혈구 주위에 환자 혈청 속에 존재하던 항체(즉, 적혈구에 결합되지 않고 용액 중에 자유롭게 떠다니던 항체)가 미량이라도 남아있게 된다면, 이 항체들이 이후의 용출 과정 중에 용출액 속으로 불가피하게 혼입될 수 있습니다. 이렇게 되면, 최종적으로 얻어진 용출액을 검사했을 때, 마치 적혈구 표면에서 실제로 용출된 항체인 것처럼 잘못된 양성 반응을 보이거나 원래 적혈구에 결합되어 있던 항체와 다른 특이성을 가진 항체가 검출되는 등 심각한 위양성(false positive) 결과를 초래할 수 있습니다.
따라서, 용출 전 세척은 일반적으로 차가운 생리식염수를 이용하여 최소 4회에서 6회 이상 반복적으로 수행하는 것이 권장되며, 특히 마지막 세척 단계 후 얻어진 상층액(supernatant)을 이용하여 간단한 단백질 검사(예: 단백질 검사 스트립 사용 또는 비탁법)를 수행하여 단백질(즉, 잔류 혈청 항체)이 거의 검출되지 않음을 확인하는 과정을 거치는 것이 결과의 정확성을 담보하기 위해 매우 중요합니다.
용출 과정이 모두 성공적으로 완료되면, 최종적으로 얻어진 맑고 투명한 용액인 '용출액(eluate)'은 이제 마치 환자의 혈청 검체와 동일하게 취급될 수 있습니다. 즉, 이 용출액은 적혈구 표면에 결합되어 있던 항체들을 농축하여 포함하고 있는 귀중한 분석 시료가 되는 것입니다.
이 용출액을 이용하여, 다양한 항원 표현형을 가진 표준 적혈구 세포들로 구성된 항체 동정용 패널 세포(antibody identification panel cells)들과 반응시켜 그 안에 어떤 특정 항원에 대해 반응하는 항체(즉, 어떤 특이성을 가진 항체)가 포함되어 있는지를 확인하는 항체 동정 검사(antibody identification)를 수행합니다. 이 용출액 항체 동정 검사 결과를 통해, 우리는 마침내 DAT 양성을 일으킨 근본적인 원인 항체가 무엇인지, HDFN을 일으킨 항체가 정확히 엄마로부터 온 Anti-A, Anti-B, 또는 Anti-D 항체인지, 혹은 지연성 용혈성 수혈 부작용을 일으킨 주범이 환자가 가지고 있던 Anti-Jka 항체였는지 등을 명확하게 규명할 수 있게 되는 것입니다.
해리 (Dissociation) : 모든 분리의 근본 원리
해리(Dissociation)라는 용어는 사실 흡착(Adsorption)이나 용출(Elution)처럼 어떤 특정 검사 기법의 명칭이라기보다는, 조금 더 근본적이고 일반적인 화학적 또는 물리적 현상을 설명하는 용어에 가깝습니다. 즉, 항원(Antigen) 분자와 항체(Antibody) 분자 사이에 형성되었던 비교적 약한 비공유결합(non-covalent bond)이 어떤 외부적인 요인(예: 온도 변화, pH 변화, 농도 변화, 경쟁적 저해제 존재 등)에 의해 약화되거나 끊어져서, 서로 결합된 상태(associated state)에서 각각의 분리된 상태(dissociated state)로 돌아가는 현상 또는 과정 그 자체를 의미합니다.
앞에서 아주 상세하게 설명한 '용출(Elution)' 검사는 바로 이러한 '해리'의 원리를 인위적으로 유도하고 제어하여 적혈구 세포 표면에 결합된 항체를 효과적으로 분리하고 회수하는 특수한 면역혈액학적 응용 기술이라고 명확하게 정의할 수 있습니다. 용출을 일으키기 위해 사용하는 다양한 방법들, 즉 온도 변화(가열, 동결-융해), pH 변화(산 처리), 또는 과거에 사용되었던 유기 용매 처리 등은 모두 근본적으로 항원-항체 간의 약한 비공유결합들을 불안정하게 만들거나 파괴하여 항체가 항원으로부터 떨어져 나오도록, 즉 '해리'를 촉진함으로써 항체를 분리시키는 구체적인 수단들인 것입니다.
한편, '해리'라는 용어가 혈액은행의 일상적인 업무나 다른 과학 분야에서 조금 다른 맥락으로 사용될 수도 있다는 점을 인지하는 것이 혼동을 피하기 위해 중요합니다. 예를 들어, 시험관 내에서 매우 강력한 적혈구 응집(agglutination) 반응이 관찰되었을 때, 이 단단하게 뭉쳐진 적혈구 응집 덩어리를 물리적인 힘(예: 시험관을 부드럽게 흔들어 주거나, 원심분리 후 침전물을 재부유시키는 과정)이나, 때로는 화학적인 처리 또는 온도 변화 등을 이용하여 개별 세포들로 다시 분산시키는 과정을 종종 '응집을 해리시킨다(dissociate the agglutination)'고 표현하기도 합니다.
이러한 조작은 주로 형성된 응집 반응의 정확한 강도(grade, 예: 4+인지 3+인지)를 판독하거나, 혼합시야(mixed-field) 반응과 같이 응집된 세포와 응집되지 않은 세포가 섞여 있는 미세한 패턴을 더 명확하게 관찰하기 위해 수행될 수 있습니다. 예를 들어, 4℃의 저온에서 매우 강력한 응집을 일으키는 한랭 응집소(cold agglutinin)가 존재하는 경우, 정확한 판독을 위해 시험관을 잠시 체온인 37℃로 가온하여 응집을 일시적으로 '해리'시킨 후 관찰하는 경우가 이에 해당합니다. 하지만 이러한 '응집 해리' 과정은 항체를 회수하여 그 특이성을 분석하는 것을 목적으로 하는 '용출(Elution)'과는 그 목적과 방법론 면에서 명확하게 구분되어야 합니다.
흡착과 용출 : 상호 보완적인 조합합
흡착(Adsorption)과 용출(Elution)은 혈액은행 검사실에서 복잡하고 어려운 항체 관련 문제들을 해결하는 데 있어, 마치 동전의 양면이나 빛과 그림자처럼 서로 떼려야 뗄 수 없는 밀접한 관계를 가지며 상호 보완적으로 사용되는 매우 중요한 전략적 도구들의 조합입니다. 이 두 기법은 각각 서로 다른 방향에서 문제에 접근하지만, 종종 하나의 복잡한 문제를 해결하거나 특정 목표를 달성하기 위해 마치 환상의 짝꿍처럼 순차적으로 또는 병행하여 함께 사용되기도 합니다.
흡착은 본질적으로 '제거(Removal)' 또는 '분리(Separation)'의 기술이라고 할 수 있습니다. 그 주된 목표는 환자의 혈청과 같은 복잡한 생체 혼합물 속에서 특정 항체(주로 문제를 일으키는 자가항체나 이미 그 정체를 알고 있는 동종항체)를 선택적으로 제거하거나, 또는 여러 항체가 섞여 있는 혼합물에서 특정 항체만을 분리해내는 것입니다. 이를 통해 그로 인해 가려져 있던 다른 중요한 항체(주로 임상적으로 유의한 동종항체)를 찾아낼 수 있는 길을 열어주거나, 복잡한 항체 혼합물을 단순화하여 분석을 용이하게 만듭니다. 즉, 흡착은 '빼기'를 통해 숨겨진 것을 드러내거나 복잡한 것을 단순화하는 전략**이라고 요약할 수 있습니다.
용출은 본질적으로 '회수(Recovery)'와 '확인(Identification)' 또는 '증명(Proof)'의 기술이라고 할 수 있습니다. 그 주된 목표는 이미 적혈구 세포 표면에 결합되어 문제를 일으키고 있는 원인 불명의 항체를 그 결합 부위로부터 효과적으로 분리하여 회수한 뒤, 이렇게 회수된 항체의 정체, 즉 어떤 특정 항원에 대해 반응하는 특이성(specificity)을 가지고 있는지를 명확하게 밝혀내는 것입니다. 이를 통해 DAT 양성, 수혈 부작용, 신생아 용혈성 질환 등의 근본적인 원인을 명확하게 규명하거나, 특정 항체의 존재를 확실하게 증명하는, '더하기' 또는 '찾아내기', '증명하기' 전략이라고 요약할 수 있습니다.
때로는 이 두 가지 강력하고 정교한 기술이 하나의 복잡한 문제를 해결하거나 특정 가설을 검증하기 위해 마치 잘 짜인 각본처럼 순차적으로 또는 병행하여 함께 사용되기도 합니다. 예를 들어, 앞서 여러 차례 언급했듯이 어떤 환자의 적혈구가 특정 항원을 매우 약하게 발현하는지 여부를 확실하게 증명하고 싶을 때 사용되는 전략을 다시 한번 살펴보겠습니다. 먼저, 그 의심되는 항원에 대한 특이성을 가진 것으로 잘 알려진 강력한 항체를 준비하여 이 환자의 적혈구와 반응시켜 항체가 적혈구에 결합하도록 유도합니다(이것이 '흡착' 단계입니다).
그런 다음, 결합하지 않고 남아있는 여분의 항체를 제거하기 위해 철저한 세척 과정을 거칩니다. 다음으로, 이 적혈구로부터 결합된 항체만을 다시 분리하여 회수합니다(이것이 '용출' 단계입니다). 마지막으로, 이렇게 얻어진 용출액 속에 들어있는 항체가 원래 실험에 사용했던 항체의 특이성과 정확히 일치하는지를 확인하는 과정을 거칩니다. 만약 용출액에서 원래 항체의 특이성이 명확하게 확인된다면, 이는 원래의 적혈구가 해당 항원을 약하게나마 가지고 있었기 때문에 항체가 결합했다가 다시 용출될 수 있었다는 강력한 증거가 됩니다. 이처럼 흡착과 용출은 서로 다른 목적과 방법론을 가지고 있지만, 복잡한 면역혈액학적 퍼즐의 조각들을 맞추는 데 있어 서로를 보완하고 때로는 서로의 결과를 검증하며 강화하는 매우 유용한 짝꿍 관계에 있다고 할 수 있습니다.
요약 및 결론
흡착(Adsorption)과 용출(Elution)은 단순히 혈액형을 맞추는 일상적인 검사의 수준을 훨씬 뛰어넘어, 혈액은행 검사실에서 일반적인 검사 방법만으로는 해결의 실마리를 찾기 어려운 복잡하고 까다로운 면역혈액학적 문제들을 해결하는 데 필수적으로 사용되는 매우 정교하고 강력한 분석 기법들입니다. 흡착 기법은 혈청이라는 복잡한 혼합물 속에서 특정 항체를 마치 자석처럼 선택적으로 제거함으로써 그 뒤에 숨겨져 있던 다른 중요한 항체를 찾아내거나 복잡한 항체 혼합물을 효과적으로 분리하는 데 핵심적인 역할을 수행합니다.
반면, 용출 기법은 이미 적혈구 세포 표면에 결합되어 문제를 일으키고 있는 항체를 직접 회수하여 그 정체를 명확하게 밝힘으로써 직접 항글로불린 검사(DAT) 양성의 근본 원인, 수혈 부작용의 원인 규명, 신생아 용혈성 질환의 확진 등 임상적으로 매우 중요한 질문들에 대한 답을 제공합니다. 이 모든 정교한 과정의 바탕에는 항원과 항체 사이의 약한 결합을 의도적으로 끊어내는 '해리(Dissociation)'의 기본 원리가 자리 잡고 있습니다.
이러한 흡착과 용출 기술들은 단순히 정해진 절차에 따라 시약을 섞고 원심분리기를 돌리며 결과를 판독하는 기계적인 과정을 훨씬 뛰어넘는 고도의 전문성을 요구합니다. 성공적인 검사 수행과 그 결과의 정확한 해석을 위해서는 항원-항체 반응의 근본적인 원리에 대한 깊이 있는 이론적 이해가 반드시 뒷받침되어야 하며, 매우 세심하고 숙련된 실험 기술이 필수적으로 요구됩니다. 뿐만 아니라, 때로는 매우 복잡하고 예상치 못한 패턴으로 나타나는 검사 결과들을 바탕으로 논리적인 추론 과정을 거쳐 임상적으로 의미 있는 최종 결론을 도출해내는 고도의 분석적인 사고 능력과 문제 해결 능력 또한 혈액은행 전문가에게 반드시 필요한 핵심적인 자질입니다.
결국, 혈액은행 전문가들은 이러한 흡착과 용출이라는 정밀한 도구들을 마치 고성능 현미경처럼 사용하여, 우리 눈에는 보이지 않는 적혈구 표면의 항원과 혈액 속 항체의 미세하고 복잡한 상호작용의 세계를 면밀하게 탐구합니다. 그리고 그 깊은 탐구를 통해 환자의 생명과 안전을 지킬 수 있는 결정적이고 귀중한 정보들을 찾아내는 중요한 역할을 묵묵히 수행하고 있는 것입니다.
흡착과 용출 검사는 혈액은행 업무의 깊이와 고도의 전문성을 상징적으로 보여주는 대표적인 예시이며, 궁극적으로는 모든 환자에게 가장 안전하고 가장 적합한 혈액 제제를 공급하기 위한 혈액은행 전문가들의 끊임없는 과학적 노력과 헌신의 중요한 증거라고 힘주어 말할 수 있겠습니다.
2025.04.07 - [수혈의학] - ABO 혈액형 항원, 검사의 모든 것 - 구조, 유전, 표현형, 그리고 검사법
ABO 혈액형 항원, 검사의 모든 것 - 구조, 유전, 표현형, 그리고 검사법
혹시 수혈이 필요했던 경험이나, 주변 사람의 수혈 경험을 들어보신 적 있으신가요? 수혈은 생명을 살리는 중요한 의료 행위이지만, 아무 혈액이나 받을 수는 없습니다. 잘못된 혈액형의 피를
labdoctor.tistory.com
'수혈의학' 카테고리의 다른 글
| 수혈 검사에서 컬럼 응집법과 마이크로플레이트법 원리, 절차, 장단점 상세 비교 (0) | 2025.04.09 |
|---|---|
| 산모 - 태아의 ABO 부적합 현상의 원리와 검사, 대응법 (1) | 2025.04.08 |
| 혼합시야반응이란 (Mixed filed agglutination) 정의, 원인, 검사법 (0) | 2025.04.08 |
| A, B형 혈액형 아형 집중 분석- 표현형, 검사법, 임상적 의의 (0) | 2025.04.08 |
| ABO 혈액형 항원, 검사의 모든 것 - 구조, 유전, 표현형, 그리고 검사법 (1) | 2025.04.07 |




댓글